Número Atual: Maio-Junho 2014 - Volume 2 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Aspectos práticos no diagnóstico e manejo das reações de hipersensibilidade a fármacos
Practical aspects in the diagnosis and management of drug hypersensitivity reactions
Ullissis P. Menezes1; Daniel L. Cordeiro1; Janaina Michelle L. Melo2
1. MD. Hospital das Clínicas da Faculdade de Medicina de Ribeirao Preto - Universidade de Sao Paulo, SP
2. MD,MSc. Hospital das Clínicas da Faculdade de Medicina de Ribeirao Preto - Universidade de Sao Paulo, SP
Endereço para correspondência:
Janaina Michelle L. Melo
E-mail: janaina_doctor@yahoo.com.br
Submetido em 12/05/2015
Aceito em: 16/05/2015
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
As reaçoes de hipersensibilidade a fármacos (RHF) podem ser de natureza alérgica ou nao alérgica, e correspondem a aproximadamente 15% de todas as reaçoes adversas a fármacos (RAF). As reaçoes alérgicas sao mediadas por mecanismo imune, nao previsíveis, podendo ser graves e até mesmo fatais, ou requererem internaçoes hospitalares prolongadas. Erros na classificaçao das RHF ocorrem com frequência, principalmente quando o diagnóstico é baseado apenas na história clínica (superdiagnóstico) ou quando as reaçoes nao sao documentadas de maneira apropriada (subdiagnóstico). O diagnóstico inadequado pode levar à exclusao desnecessária, com diminuiçao das opçoes terapêuticas, e ao uso de fármacos alternativos ineficazes e/ou de custo elevado. Os grupos de fármacos mais comumente envolvidos em reaçoes de hipersensibilidade sao os betalactâmicos e os anti-inflamatórios nao esteroidais (AINEs). Consensos atuais preconizam uma investigaçao diagnóstica sistematizada das RHF através da realizaçao de testes cutâneos, laboratoriais e testes de provocaçao, direcionados por uma história clínica detalhada. O objetivo do presente estudo é abordar aspectos práticos do diagnóstico e manejo das reaçoes de hipersensibilidade a fármacos, com ênfase aos betalactâmicos e AINEs, de acordo com os estudos e consensos atuais.
Descritores: Hipersensibilidade a drogas, alergia, imunologia.
ASPECTOS GERAIS DAS REAÇÕES DE HIPERSENSIBILIDADE A FÁRMACOS
As reações de hipersensibilidade a fármacos (RHF) são eventos adversos desencadeados por um ou mais fármacos ou seus excipientes e afetam por volta de 7% da população geral, constituindo um importante problema de saúde pública1,2. Estudos indicam que as RHF são responsáveis por aproximadamente 6,5% das admissões hospitalares, e que cerca de 15% dos pacientes internados tem seu tempo de permanência hospitalar prolongado devido a RHF3,4.
A Organização Mundial de Saúde define as RAF em dois tipos: tipo A (85%), relacionadas com efeitos farmacológicos da droga, dose-dependente, na maioria dos casos são reações previsíveis; e as do tipo B (15%), geralmente reações dose-independente, não previsíveis, prejudiciais e não intencionais quando os fármacos são utilizados em doses normais5,6.
Fatores de riscos para o desenvolvimento de RHF foram identificados, sendo a história de reação prévia a um fármaco e a componentes com estrutura química semelhante o fator mais importante6,7. As reações são denominadas alérgicas quando um mecanismo imunológico envolve anticorpos específicos ou células T. Devido à heterogeneidade das apresentações clínicas das RHF e à limitação de conhecimentos em relação aos mecanismos imunes envolvidos, a classificação destas reações ainda constitui um desafio na prática clínica. A padronização da classificação é de grande importância, pois permite a comparação entre estudos e também a validação de técnicas diagnósticas.
Classificação clínica das reações de hipersensibilidade
As reações adversas aos fármacos são classificadas em imediatas e não imediatas ou tardias, dependendo do tempo de início da manifestação após a exposição ao fármaco.
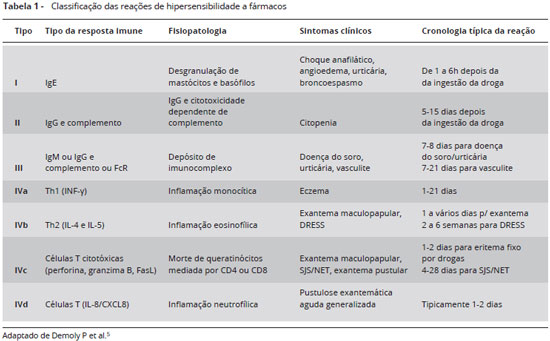
Reações imediatas ocorrem frequentemente até 1 hora após a exposição ao fármaco, podendo se estender até 6 horas, e na maioria dos casos envolve um mecanismo imune com produção de anticorpos da classe IgE antígeno-específicos. Estes anticorpos ligam-se a receptores de alta afinidade (FceRI) na superfície de mastócitos e basófilos. Em exposição subsequente ao antígeno (hapteno) do fármaco, na forma de complexo associado a proteína, este se liga a anticorpos IgE e estimula a liberação de mediadores pré-formados (histamina, triptase) e a produção de novos mediadores (leucotrienos, prostaglandinas, citocinas). Os mediadores pré-formados estimulam uma resposta inflamatória alérgica em minutos. As principais manifestações são urticária, angioedema, conjuntivite, rinite, obstrução brônquica, sintomas gastrointestinais (náuseas, vômitos, diarreia, dor abdominal), anafilaxia incluindo o choque anafilático (Figura1)8.
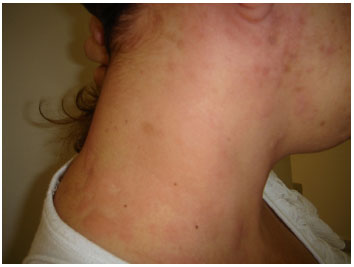
Figura 1 - Reação de hipersensibilidade imediata: urticária por amoxicilina
As reações não imediatas ou tardias ocorrem após 1 hora até dias da exposição ao fármaco, e são frequentemente associadas a mecanismos imunológicos envolvendo linfócitos T. Através do reconhecimento de peptídeos imunes, estes antígenos são processados por células dendríticas, internalizados e transportados para os linfonodos. Para que ocorra uma resposta imune efetiva, o sistema imune inato necessita ser ativado e o antígeno ser apresentado às células T virgens; alguns antígenos podem estimular diretamente os linfócitos T que migram para órgãos alvos. Após reexposição ao antígeno, os linfócitos secretam mediadores e citocinas (perforinas, granzimas e granulisinas) que lesam os tecidos. Em situações frequentes, fármacos não são compostos por proteínas imunogênicas e a formação de haptenos ocorre como consequência da ativação metabólica do fármaco (hipótese pro-hapteno, metabólito reativo). Em outra forma de ativação do sistema imune (p-i concept), o fármaco interage diretamente com receptores e ativa o linfócito T ligando-se ao MHC (complexo de histocompatibilidade maior) ou através de moléculas do HLA (antígeno leucocitário humano). As manifestações tardias mais frequentes são exantema máculo-papular e urticária tardia. Outras manifestações são: eritema pigmentar fixo, vasculite, necrólise epidérmica tóxica, síndrome de Stevens Johnson, DRESS (drug reaction with eosinophilia and systemic symptoms), e acometimento de órgãos específicos (hepatite, pneumonite, falência renal, anemia, neutropenia e trombocitopenia)8.
Fármacos são capazes de induzir todos os tipos de reações imunológicas descritas por Gell e Coombs, porém as mais comuns são as reações do tipo I mediadas por IgE e as reações do tipo IV mediadas por linfócitos T (Tabela 1). Fatores como vias de administração, papel dos metabólitos, utilização de outros fármacos no mesmo período, doenças infecciosas ou autoimunes, podem acelerar ou retardar o início e a progressão das reações9.
Em vários contextos clínicos, reações com sintomas sugestivos de alergia são erroneamente consideradas como reações alérgicas a fármacos. Alguns mecanismos patológicos sugerem tais situações, incluindo: liberação inespecífica de histamina por mastócitos e basófilos (opiáceos, meios de contraste); acúmulo de bradicinina pela utilização de inibidores da enzima conversora de angiotensina; ativadores do sistema complemento (protamina); alteração do metabolismo do ácido araquidônico (ação dos AINEs) e ação farmacológica de determinados medicamentos (broncoespasmo induzido por betabloqueador)5,6.
Diagnóstico das reações de hipersensibilidade a fármacos
O diagnóstico definitivo das RHF é fundamental para estabelecer medidas preventivas apropriadas. A história clínica detalhada é a primeira etapa para o diagnóstico das RHF, porém quando utilizada isoladamente pode levar ao diagnóstico equivocado. O diagnóstico definitivo deve ser baseado na história clínica detalhada, testes cutâneos padronizados, testes in vitro confiáveis e testes de provocação5,6,10.
História clínica
A história clínica deve ser detalhada e utilizar questionários clínicos padronizados ou modificados11,12.
São relevantes os seguintes aspectos:
1 - Fármaco:
a. Composição, dose, via e tempo de administração, intervalo de tempo entre a administração e início dos sinais e sintomas;
b. Identificação de todos os fármacos utilizados na ocasião da reação;
c. Investigação sobre a reutilização do fármaco suspeito e se houve reação ou tolerância;
d. História de reações prévias ao fármaco suspeito ou de estrutura química semelhante.
2 - Sinais e sintomas clínicos: duração, documentação das reações (fotos) e resposta ao tratamento.
3 - Atentar para a doença de base como possível causa das manifestações clínicas.
4 - Intervalo de tempo entre a ocorrência da reação e a avaliação pelo especialista: sabe-se que nas reações do tipo IgE-mediadas a reatividade cutânea diminui com o tempo e os testes cutâneos podem se tornar negativos.
Testes diagnósticos
De acordo com o consenso internacional de alergia a fármacos5, deve-se realizar testes diagnósticos de provocação nas seguintes situações:
1 - Paciente com história prévia de RHF, quando esta droga é essencial ao tratamento da doença de base sem uma alternativa igualmente efetiva, segura e de estrutura química não relacionada, e que a relação risco-benefício seja positiva;
2 - História de reação grave a outro fármaco, em que a investigação torna-se o caminho mais seguro para o paciente descobrir qual é o fármaco implicado.
Para fármacos utilizados em larga escala no mundo todo, como os antibióticos betalactâmicos, AINEs e anestésicos locais, a suspensão do fármaco pode levar à contraindicação de fármacos que não necessariamente induziram reações. Todas as investigações deverão ser feitas após 6 semanas da resolução completa dos sinais clínicos. É importante considerar que alguns testes podem se tornar negativos em tempo superior a 6 a 12 meses do episódio da reação5.
Testes cutâneos
Os testes cutâneos auxiliam na confirmação ou exclusão da sensibilização, porém o seu valor diagnóstico não tem sido avaliado para todos os fármacos. Devem ser seguidas todas as normas de padronização: testes devem ser realizados cerca de 4-6 semanas após a reação, e a indicação do teste dependerá do mecanismo patológico envolvido na RHF5,13.
Os testes cutâneos de puntura (prick test) e intradérmico são importantes para demonstrar evidência de sensibilização a um fármaco específico, porém devem ser interpretados dentro do contexto clínico de uma reação alérgica IgE mediada (Figura 2)13.
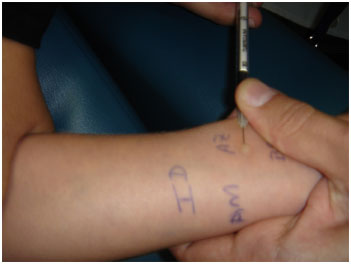
Figura 2 - Teste cutâneo intradérmico
Aspectos práticos do teste cutâneo de puntura (prick test)13:
- Realizar controle positivo com histamina e controle negativo com solução salina;
- Leitura realizada em 15-20 minutos;
- Ausência de utilização de fármacos inibidores da resposta: anti-histamínicos suspender 3-7 dias antes do teste, e antidepressivos tricíclicos 3-4 semanas;
- Positividade: pápula com diâmetro igual ou maior a 3 mm em relação ao controle negativo;
- Falso-positivo e negativo: quando drogas não causadoras de reação IgE mediada são utilizadas ou quando utilizam-se concentrações não validadas;
- Afastar dermografismo;
- Realizar em áreas da pele sem lesões;
- São mais específicos e seguros, e menos sensíveis do que os testes intradérmicos.
Aspectos práticos do teste cutâneo intradérmico13:
- Injeta-se 0,03 mL do fármaco via intradérmica;
- Inicia-se concentração 10-5 a 10-1 da concentração utilizada no teste de puntura (prick test);
- Se negativo, aumenta-se 10 vezes a concentração até positivar ou atingir concentração mais elevada não irritante;
- Leitura realizada em 15-20 minutos;
- Utilizar preparações parenterais;
- Possibilidade maior de ocorrência de reações sistêmicas se comparado ao teste de puntura (prick test).
Para reações imediatas, o teste de puntura (prick test) é recomendado como screening inicial, pois apresenta elevada especificidade, baixo custo e rápida resposta. O teste intradérmico é realizado quando o teste de puntura for negativo; apresenta maior sensibilidade que o prick e sempre que possível deve ser realizado com a apresentação parenteral do fármaco. A sensibilidade e o valor preditivo variam muito, dependendo do fármaco suspeito e da apresentação clínica. Os testes cutâneos para betalactâmicos, bloqueadores neuromusculares, sais platinum e heparina e para diversos outros fármacos estão em concentrações sistematizadas13.
As reações não imediatas ocorrem horas após a exposição ao fármaco e são demonstradas através de um mecanismo que envolve linfócitos T. Os testes intradérmicos de leitura tardia e o teste de contato são utilizados para avaliação destas reações10,14. No entanto, as concentrações para muitos alérgenos e excipientes não têm sido ainda padronizadas e validadas, e são ainda discutidas na literatura. Em alguns casos o fármaco não está disponível em sua forma reativa, sendo seu metabólito o componente imunogênico; nestas situações são necessários testes de provocação para se estabelecer o diagnóstico13,15.
Aspectos práticos do teste de contato (patch test)13:
- Envolve a aplicação direta sobre a pele, de alérgenos potenciais em concentrações não irritantes sob discos de contenção (chambers);
- Duas leituras: 48 e 96 horas;
- Experiência é necessária para diferenciar reação verdadeira de falso-positivo irritante;
- Falso-negativo ocorre ao se utilizar baixa dose do fármaco ou por baixa penetração na pele;
- Sensibilidade varia entre 11 e 43% (estudos em diferentes populações);
- Concentrações variam entre 1%, 5% e 10%;
- Reações cutâneas graves (Necrólise epidérmica tóxica / Síndrome Stevens Johnson): iniciar com concentrações ainda menores.
Testes in vitro
A quantificação da IgE específica a um fármaco baseia-se na detecção do complexo anticorpo-carreador-hapteno (fármaco). O hapteno (fármaco) conjugado a um carreador é acoplado a uma fase sólida e incubado com o soro do paciente. A quantidade de IgE específica ligada é detectada secundariamente com o anticorpo anti-IgE marcado com radioisótopo (Radioimmunoassay - RIA); por método colorimétrico (Enzyme-linked immunosorbent assay - ELISA) ou por leitura de fluorescência (Fluorescente enzyme immuno-assay - FEIA). Os resultados são expressos em unidades de 0,1 a 100 KUA/L, porém o número de testes disponíveis e validados são limitados a alguns fármacos. O nível de corte para positividade utilizado é 0,35 KUA/L16,17.
Os testes disponíveis para auxiliar o diagnóstico das RHF ainda apresentam uma baixa sensibilidade (10-50%); entretanto uma especificidade elevada (> 90%)18.
Diante destas limitações, a interpretação dos resultados deve ser bastante criteriosa. Um teste in vitro negativo não exclui a relação causal do fármaco suspeito, ao passo que um resultado positivo mostra uma sensibilização mas nem sempre indica uma real causalidade. Um paciente com história clínica de reação súbita grave à penicilina, com teste cutâneo e/ou dosagem de IgE específica positivos a este fármaco, tem reação de hipersensibilidade imediata à penicilina confirmada.
O ENDA (European Network of Drug Allergy) e a EAACI (European Academy of Allergy and Clinical Immunology) advogam que, em reações imediatas graves aos antibióticos, seja realizada dosagem de IgE específica ao fármaco implicado quando este teste for disponível e se negativo, realizar teste cutâneo5,6,13.
Testes de ativação de basófilos (TAB) por citometria de fluxo parecem promissores e estão sob validação para certos fármacos. Apresentam uma sensibilidade aproximada de 50% e especificidade de 93% para betalactâmicos17,19-21. A mensuração de mediadores liberadores de basófilos como leucotrienos e histamina é realizada através do uso de marcadores como CD63 e CD203c, porém não estão disponíveis para serem utilizados com frequência na prática clínica. Portanto, os testes in vitro, apesar das limitações dos métodos disponíveis, podem ser utilizados como testes complementares para aumentarem a sensibilidade do procedimento diagnóstico22.
Testes de provocação (TP)
Os testes de provocação com fármacos são considerados padrão-ouro para confirmar ou excluir o diagnóstico do agente implicado na reação ou para escolha de um fármaco alternativo seguro. A maioria dos consensos colocam o teste de provocação como uma das etapas finais dos algoritmos de avaliação5,6,23.
O TP independe da patogênese e não pode diferenciar RHF alérgica da não alérgica. Fatores individuais como predisposição genética e metabolismo são importantes. O teste apresenta elevada sensibilidade, deve ser realizado em ambiente hospitalar com equipamento adequado e sob supervisão de um especialista treinado e capaz de atender possíveis reações graves24.
O TP deve ser realizado no mínimo 4 semanas após a RAF, com o paciente estável, sempre que possível com o fármaco implicado e utilizando a mesma via de administração. A maioria dos testes são realizados por via oral pela segurança. Alguns grupos de fármacos são mais investigados através do TP quando os testes cutâneos forem negativos como: AINEs, anestésicos locais e antibióticos6,10,25. Na vigência de uma história clínica com elevado valor preditivo positivo, é mais sensata a realização direta de TP com fármaco alternativo, por exemplo, com inibidor da enzima cicloxigenase 2 (Cox 2) em pacientes multirreatores aos AINEs25,26.
São contraindicações para realizar os TP as reações cutâneas graves, incluindo Síndrome de Stevens Johnson, Necrólise Epidérmica Tóxica, DRESS, vasculites, AGEP (Acute Generalized Exanthematous Pustulosis); reações hematológicas e envolvimento de órgãos específicos. Além disso, os TP não devem ser indicados nas seguintes situações: quando o fármaco implicado não é essencial ao tratamento ou existem várias alternativas; presença de doença grave ou gestação (a não ser que o fármaco seja essencial para a presente doença ou durante a gestação). Os protocolos dos procedimentos de provocação variam entre serviços e consensos27-29.
O teste de provocação mais empregado na avaliação das RHF é o teste de provocação oral (TPO) simples-cego placebo controlado. A dose inicial depende da gravidade da reação prévia, da dose que causou a reação e da via de administração oral ou parenteral. O fármaco pode ser administrado em doses progressivas com intervalos de 30-180 minutos entre cada etapa30. A primeira etapa inicia-se com administração de placebo e segue-se com administração do fármaco nas concentrações sucessivas progressivas de 10%, 20%, 30% e 40% da dose total, sendo que ao final do TPO soma-se uma dose acumulativa de 100% da dose terapêutica do respectivo fármaco. Se o paciente apresentar qualquer alteração clínica, o teste é interrompido e considerado positivo. Deve-se manter o paciente em observação clínica por no mínimo 1 hora após término da última etapa (período de maior ocorrência de reações graves). Há uma tendência em se utilizar a via oral para minimizar riscos de reações graves. Deve-se certificar da ausência de uso prévio ao teste de corticosteroides, antidepressivos tricíclicos e anti-histamínicos. Os betabloqueadores devem ser suspensos pelo menos 24 horas antes da realização do TP. O termo de consentimento livre esclarecido do paciente ou responsável deve ser obtido por escrito antes de realizar o procedimento5,6,12,23,24.
Estudos mostram elevado valor preditivo negativo (VPN) do TP para betalactâmicos, de 94 a 98% em adultos e crianças, e para AINEs de 96%31-33.
Em pacientes gestantes com sífilis e reação de hipersensibilidade à penicilina, em se tratando de um fármaco essencial ao tratamento, deve-se considerar realização de dessensibilização34,35.
ASPECTOS IMPORTANTES NO MANEJO DAS REAÇÕES ADVERSAS AOS FÁRMACOS
Medidas preventivas efetivas dependem de um diagnóstico adequado de RHF. Ressaltam-se os seguintes aspectos na prevenção36:
a - Fornecer por escrito os fármacos a serem suspensos e identificá-los em documento visível na carteira ou objetos (pulseira ou colar);
b - Listar fármacos alternativos relacionados estruturalmente ao implicado (reações cruzadas);
c - Informar que o uso de pré-medicação não previne reações anafiláticas IgE mediadas;
d - Em reações graves não imediatas, o fármaco implicado deve ser excluído, pois o retardo na suspensão é fator de mau prognóstico.
DESSENSIBILIZAÇÃO
A dessensibilização constitui uma forma de abordagem das RHF, através da indução temporária de tolerância a um fármaco responsável pela reação de hipersensibilidade. As indicações principais de dessensibilização são quando o fármaco implicado na reação é essencial ao tratamento da doença de base e não há alternativa disponível, ou quando o fármaco alternativo não é eficaz. Por exemplo, quimioterápicos em pacientes oncológicos; sulfonamidas em pacientes com HIV; hipersensibilidade a quinolonas em pacientes com fibrose cística; drogas antituberculosas; hemocromatose com alergia à desferroxamina; aspirina e AINEs em pacientes reumatológicos e cardiopatas6,19,37,38.
Consensos recomendam protocolos aplicados com sucesso em reações do tipo imediatas, porém não há protocolos amplamente aceitos39. EAACI/ENDA recomendam que a dessensibilização em reações de hipersensibilidade tardia sejam restritas aos exantemas não complicados e eritema pigmentar fixo40. Em reações não imediatas, a literatura é mais limitada e mais controversa5,6.
BETALACTÂMICOS
Os antibióticos betalactâmicos apresentam como características principais o anel betalactâmico e as cadeias laterais em suas estruturas químicas. Os principais grupos incluem penicilinas, cefalosporinas, carbapenens e monobactans. As penicilinas e as cefalosporinas são os antibióticos que mais frequentemente causam RHF pela habilidade de formarem conjugados com proteínas séricas e pela frequente utilização como antimicrobianos. A penicilina é a principal causa de alergia por fármacos, com prevalência entre 5 a 10% em crianças e adultos7,41.
Fármacos como amoxicilina e cefalosporinas têm sido utilizados em substituição à benzilpenicilina, ganhando importância como causa de reações alérgicas em diversos centros, destacando a presença das cadeias laterais em suas estruturas como determinantes antigênicos19,34.
As penicilinas são fisiologicamente degradadas em reativos intermediários que agem como haptenos e ligam-se a proteínas próprias. Cerca de 95% da penicilina é degrada em Peniciloil (determinante antigênico maior), podendo induzir anticorpos da classe IgG e IgM, responsáveis pelas reações tardias. Aproximadamente 5% da penicilina é degradada em peniciloato e peniloato (determinantes antigênicos menores), responsáveis pelas reações alérgicas graves do tipo imediata envolvendo anticorpos da classe IgE42.
Devido à grande heterogeneidade da estrutura química e da capacidade de formarem conjugados, facilitando o processamento e apresentação antigênica, o grupo dos betalactâmicos pode causar uma variedade de sintomas e sinais clínicos. A presença de processo infeccioso viral aumenta a incidência de reações de hipersensibilidade aos antibióticos. As reações de hipersensibilidade imediata aos betalactâmicos são as que ocorrem mais frequentemente até 1 hora após a última exposição ao fármaco, e na maioria são mediadas por anticorpos da classe IgE. Os sintomas incluem urticária, angioedema, rinite, conjuntivite, broncoespasmo, sintomas gastrointestinais, anafilaxia e choque anafilático. As reações não imediatas ou tardias ocorrem após 1 hora da exposição ao fármaco e envolvem mecanismo celular tardio por linfócitos T. Os sintomas incluem exantema maculo-papular, urticária tardia, angioedema, eritema pigmentar fixo, reações graves como síndrome de Stevens Johnson, necrólise epidérmica tóxica, pustulose exantemática generalizada aguda e envolvimento de órgãos específicos (nefrite, hepatite, pneumonite).
Os principais consensos e estudos indicam que a confirmação diagnóstica das reações de hipersensibilidade aos betalactâmicos é realizada através de história clínica detalhada, testes in vitro, testes cutâneos e testes de provocação. Apenas 10 a 20% dos pacientes com história de reação aos betalactâmicos terão diagnóstico confirmado após a investigação5,12,14,23,34,43,44.
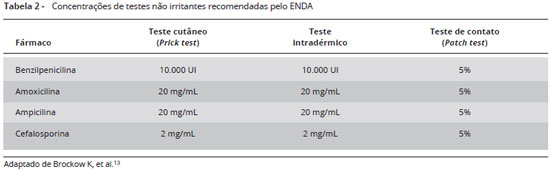
Para avaliação inicial das reações do tipo imediata aos betalactâmicos, combinamos a dosagem de IgE específica por ImmunoCAP (técnica mais validada para penicilina) aos testes cutâneos de puntura e intradérmico. A Tabela 2 mostra o painel de padronização das concentrações dos principais reagentes utilizados nos testes cutâneos com penicilina: PPL (Peniciloil Polilisina); MDM (Mistura de determinantes menores); amoxicilina e betalactâmicos relevantes5,34.
O PPL e MDM são disponíveis comercialmente em alguns países, em outros são sintetizados localmente ou recomenda-se a utilização da penicilina G potássica (Benzilpenicilina) na concentração de 10.000 U/mL. O preparo da penicilina G potássica pode ser realizado através de diluições. Estudos mostram que, quando se testam apenas PPL e BP, sem utilizar o MDM (peniloato e peniciloato), pode haver perda diagnóstica em 10-20% dos casos. Entretanto, estudos na América do Norte constataram resultados semelhantes aos testes com PPL, BP e MDM45.
A predisposição genética à alergia aos betalactâmicos tem sido descrita, relacionando um polimorfismo em genes imune moduladores (IL4, IL4R, IL13); HLA A2 DRW52; betalactamase em pacientes alérgicos à penicilina e recentemente polimorfismos em genes do NOD2 (nucleotide-binding oligomerization domain)46.
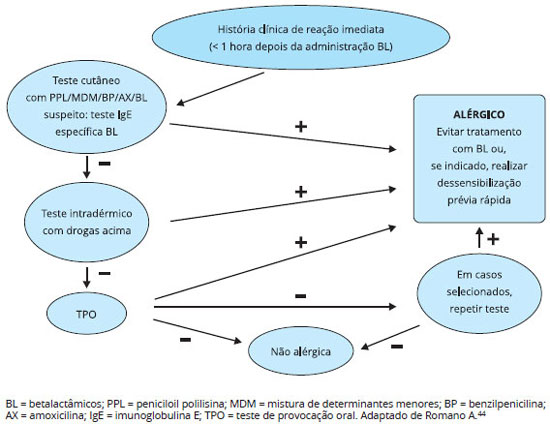
Os testes cutâneos constituem os principais métodos para o diagnóstico de reações imediatas aos betalactâmicos, segundo os principais estudos e guidelines, incluindo os do EAACI/ENDA e da American Academy of Allergy, Asthma, and Immunology (AAAAI). Esses guias recomendam, entretanto, realizar dosagem de IgE específica, se disponível, antes de realizar os testes cutâneos, em casos recentes de anafilaxia para evitar riscos de reações graves ao teste. A investigação sistematizada poder ser conduzida através do algoritmo para o diagnóstico das reações de hipersensibilidade imediata aos betalactâmicos (Figura 3)31,44.
As reações de hipersensibilidade tardia podem ser muito heterogêneas e os sintomas podem se assemelhar a doenças infecciosas. A presença concomitante de infecções bacterianas e principalmente virais favorece o aparecimento de uma reação de hipersensibilidade a fármacos. Estudos preconizam utilização de testes cutâneos de leitura tardia, intradérmico e teste de contato. O teste de contato usualmente é realizado na concentração de 5% em petrolatum; em reações graves como Stevens Johnson e necrólise epidérmica tóxica utilizar com muito critério, e em concentrações menores. Para reações como pustulose exantemática generalizada aguda ou sintomas sistêmicos associados à eosinofilia por drogas, se o teste de contato for negativo, indica-se iniciar teste intradérmico de leitura tardia em concentrações menores34,44.
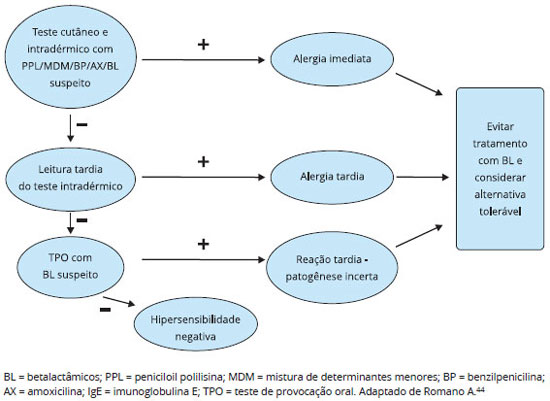
O teste intradérmico é preferencialmente mais indicado em casos de exantemas morbiliformes leves. O teste de provocação é contraindicado em reações graves, pelos riscos associados. Para as reações de hipersensibilidade tardia, estudo sistematizado pode ser utilizado através do algoritmo prático da Figura 444.
O EAACI/ENDA consideram o teste de provocação padrão-ouro para estabelecer o diagnóstico definitivo em pacientes com história sugestiva de reação de hipersensibilidade imediata mas com testes diagnósticos negativos5. Protocolo utilizando teste de provocação prolongado por 5 dias em crianças com história de reações leve a moderada de hipersensibilidade tardia à amoxicilina tem sido descritos com aumento da sensibilidade diagnóstica47.
CONSIDERAÇÕES EM RELAÇÃO A PACIENTES COM HISTÓRIA DE REAÇÃO À PENICILINA QUE NECESSITAM UTILIZAR CEFALOSPORINAS
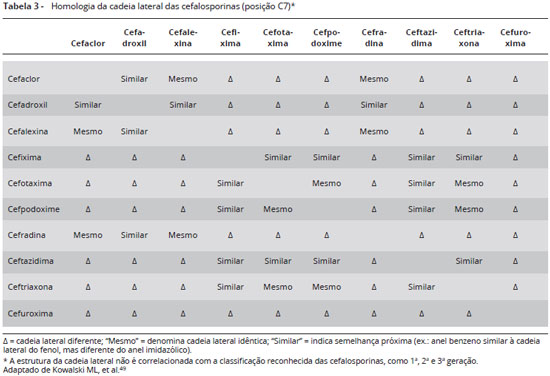
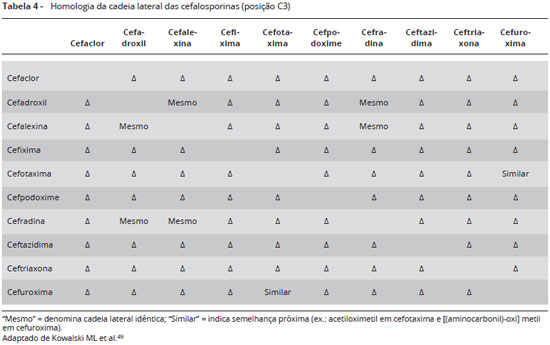
Penicilinas e cefalosporinas apresentam reações cruzadas por apresentarem o anel betalactâmico como determinante antigênico comum. Cerca de 2% dos pacientes com testes cutâneos positivos à penicilina reagem a cefalosporinas de primeira geração. Em pacientes com história de reação à penicilina e que necessitam utilizar uma cefalosporina, deve-se realizar teste cutâneo com a penicilina; caso seja negativo, a cefalosporina pode ser administrada de forma segura. Um teste cutâneo positivo com cefalosporina em concentrações não irritantes sugere fortemente a presença de anticorpos específicos da classe IgE. Por outro lado, um resultado negativo não descarta a possibilidade de reação de hipersensibilidade por não se conhecer o valor preditivo negativo deste teste34.
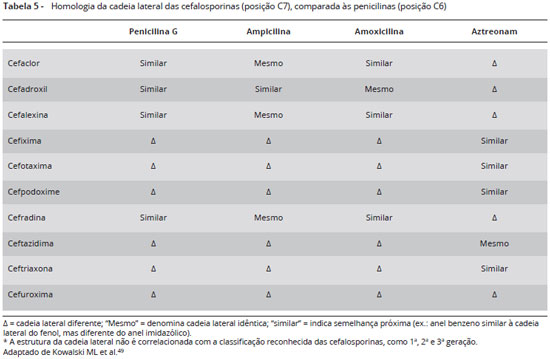
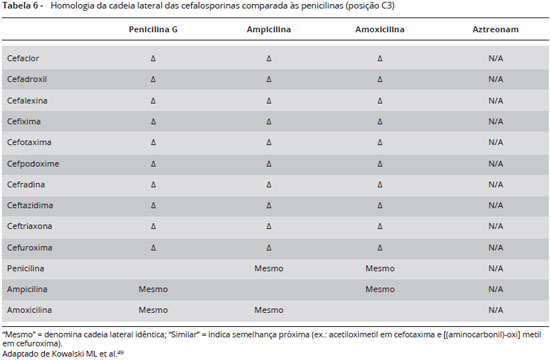
Pacientes com história de reação tipo imediata a uma cefalosporina deverão evitar a utilização de cefalosporina que compartilhe a mesma estrutura da cadeia lateral. Cefalosporinas de cadeia lateral diferentes poderão ser administradas em doses crescentes na forma de teste de provocação em ambiente hospitalar sob supervisão médica (Tabelas 3 e 4). Pacientes alérgicos à amoxicilina deverão evitar cefalosporinas com cadeias laterais semelhantes (cefadroxila, cefprozil) e da mesma forma, alérgicos à ampicilina deverão evitar fármacos de estrutura semelhantes (cefalexina, cefaclor, loracarbef) (Tabelas 5 e 6)34.
PACIENTES COM HISTÓRIA DE REAÇÃO A CEFALOSPORINAS E QUE NECESSITAM UTILIZAR PENICILINA
Pacientes com história de reação a cefalosporinas deverão ser submetidos ao teste cutâneo e ao teste de provocação com penicilina em ambiente hospitalar antes da administração. Se o resultado for negativo, poderá ser administrada a penicilina; porém, se for positivo, outro fármaco alternativo deverá ser utilizado ou se não disponível, deverá ser analisada a possibilidade de dessensibilização12,34.
ANTI-INFLAMATÓRIOS NÃO ESTEROIDAIS (AINEs)
Os anti-inflamatórios não esteroidais (AINEs) são os fármacos mais comumente envolvidos em reações de hipersensibilidade, juntamente com o grupo dos antibióticos. Por serem os medicamentos mais prescritos no mundo e de fácil acesso, podem induzir a uma variedade de reações adversas do tipo A (previsíveis e relacionadas às suas propriedades farmacológicas), e do tipo B (não previsíveis e relacionadas à susceptibilidade individual), envolvendo uma resposta imune (alérgica) ou não alérgica, por mecanismo farmacológico não específico de inibição da enzima cicloxigenase (Cox)48,49.
Classificação de acordo com a estrutura química
Os AINEs são fármacos de diferentes estruturas químicas com capacidade para inibir a enzima cicloxigenase (Tabela 7)49. Esta inibição provoca um desvio no metabolismo do ácido araquidônico para produção de leucotrienos. O mecanismo pelo qual os AINEs induzem uma RHF está associado à liberação de mediadores vasoativos (histamina, prostaglandinas e leucotrienos) através da inibição da cicloxigenase. Além disso, AINEs podem induzir reação de hipersensibilidade através de uma resposta imune mediada por anticorpos da classe IgE ou linfócitos T48,50-52.
Manifestações clínicas
Na classificação das reações de hipersensibilidade aos AINEs consideram-se53:
- tempo de início da reação (aguda ou tardia);
- características clínicas dos sintomas;
- reatividade cruzada (presença ou ausência de tolerância cruzada a outros AINEs não relacionados quimicamente);
- doenças sobrepostas;
- mecanismos fisiopatológicos envolvidos.
A classificação fenotípica permite o uso de um algoritmo para diagnóstico baseado na história e mecanismos imunes envolvidos (Figura 5)49. A prevalência das RH aos AINEs na população geral varia entre 0,6 a 5,7%, dependendo do grupo étnico estudado, critérios utilizados para diagnóstico e tipos de reações. Estudo indicou que 55% de pacientes rotulados como apresentando hipersensibilidade aos AINEs de acordo com história clínica toleraram AINEs após realização de teste de provocação54.
A EAACI reconhece cinco entidades clínicas49,52-55:
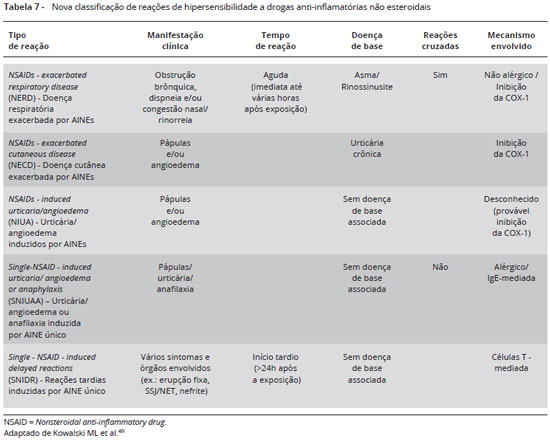
1 - Doença respiratória exacerbada por AINEs/NERD - NSAIDs - exacerbated respiratory disease: associa-se à presença de asma, polipose nasossinusal, rinossinusite crônica; exacerbação de rinite e/ou asma, surgimento de dispneia e/ou broncoespasmo nas primeiras 2 horas de exposição a AINEs;
2 - Doença cutânea exacerbada por AINEs/NECD - NSAIDs - exacerbated cutaneous disease: ocorre em pacientes com urticária crônica espontânea. Sintomas de urticária e/ou angioedema ocorrem após administração de AINEs, dependentes da potência de inibição da Cox-1 e da atividade da urticária crônica espontânea;
3 - Angioedema/urticária induzidos por AINEs/NIUA - NSAIDs - induced urticaria/angioedema: angioedema e urticária após uso de diferentes AINEs, sem urticária crônica espontânea de base, com sintomas desaparecendo após suspensão do fármaco;
4 - Anafilaxia/angioedema/urticária induzidos por único AINE/SNIUAA - Single-NSAID-induced urticaria/angioedema or anaphylaxis: ocorrem sintomas de urticária, angioedema e/ou anafilaxia na primeira hora após exposição a um único AINE, com boa tolerância a outros AINEs, mesmo àqueles que são fortes inibidores da Cox-1. Os fármacos mais envolvidos neste tipo de reação incluem derivados da pirazolona, ibuprofeno, diclofenaco, aspirina e paracetamol;
5 - Reações de hipersensibilidade tardia induzidas por único AINE/SNIDR Single-NSAID-induced delayed reactions: reações menos frequentes, predominantemente cutâneas, incluindo exantemas maculopapulares, eritema pigmentar fixo, além de febre e envolvimento de órgãos em algumas situações. O desenvolvimento de sintomas ocorre após 24 horas após a ingestão do AINEs. A Síndrome de Stevens Johnson é rara.
Entretanto, alguns pacientes não se enquadram em nenhuma das categorias acima, incluindo pacientes com reações envolvendo tanto sintomas cutâneos como sintomas respiratórios.
Diagnóstico
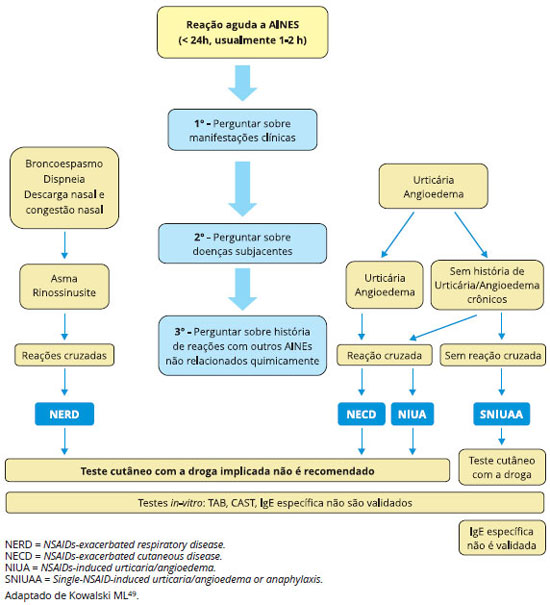
O diagnóstico deve ser direcionado pela história clínica detalhada, sendo importante estabelecer se o paciente reage a múltiplos AINEs (RH mediada por mecanismo não-imunológico) ou a único AINE (RH mediada por mecanismo imunológico). Para os pacientes com RH mediada por mecanismo não-imunológico, os testes cutâneos e laboratoriais não apresentam valor, entretanto pacientes com RH mediada por mecanismo imunológico podem ter benefícios na investigação, considerando as limitações destes testes para esta classe de fármacos56. A utilidade do teste cutâneo com alguns fármacos como pirazolona tem sido relatada em casos de angioedema, urticária e anafilaxia induzidas por único fármaco, porém a sensibilidade não é adequada, e existem riscos de resposta sistêmica ao teste57. Em indivíduos com reações tardias induzidas por único AINE, os testes cutâneos não têm sido padronizados para uso na prática clínica, mas podem ter sua utilidade. Teste de contato tem sua aplicabilidade em dermatite de contato e também para reações foto-alérgicas e foto-tóxicas50,58,59.
Testes in vitro apresentam limitações importantes para utilização diagnóstica na prática clínica. A dosagem de anticorpos da classe IgE em indivíduos com história de urticária, angioedema e/ou anafilaxia a único AINE tem sido realizada para fármacos como aspirina, ibuprofeno, diclofenaco e derivados da pirazolona, porém a falta de disponibilidade comercial destes testes limita sua utilização57. O teste de ativação de basófilos em reações mediadas por IgE aos derivados da pirazolona tem sido utilizado mostrando sensibilidade de aproximadamente 50% e especificidade de 90%60.
O teste de provocação tem importante papel na confirmação diagnóstica quando não há um fármaco alternativo e na identificação de AINE alternativo seguro para uso, uma vez que o diagnóstico tenha sido confirmado. O teste identifica indivíduos reatores seletivos e provê alternativas seguras. Usualmente dá-se preferência aos inibidores da Cox-2 e inibidores fracos da Cox-1 em indivíduos com reações a múltiplos AINEs (Figura 6). O teste de provocação é o único método disponível para diagnosticar pacientes com reações não-imunológicas com sintomas cutâneos (doença cutânea exacerbada por AINEs, e urticária/angioedema induzidos por AINEs)49.
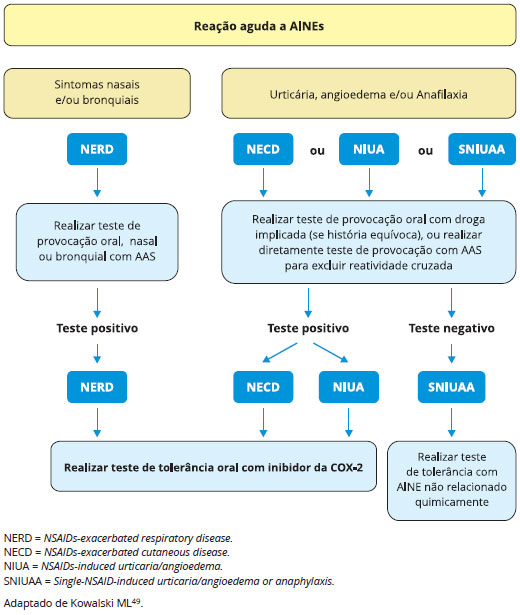
Figura 6 - Algoritmo para teste de provocação com AINEs em pacientes com história de reações agudas
Em paciente suspeito de reação imune-mediada, a primeira etapa é verificar a história de tolerância a outro inibidor forte da Cox-1. Se não for possível identificar, deve-se realizar teste de provocação com outro inibidor forte da Cox-1 de estrutura química não relacionada. Se o teste for positivo, o paciente é considerado intolerante cruzado, e a resposta seletiva é afastada.
É importante ressaltar que a realização do teste de provocação com AINEs é contraindicada nas seguintes situações: asma não controlada (VEF1 < 1,5 L); variabilidade de VEF1 com placebo > 20%; reações cutâneas graves; doenças infecciosas, doenças psiquiátricas; choque anafilático e reações em órgãos específicos50,55,61.
É importante também fornecer lista de AINEs a serem evitados e lista com fármacos alternativos para serem utilizados.
Em pacientes com doença respiratória exacerbada por AINEs, a tolerância à aspirina pode ser induzida através da dessensibilização53,61. Quando dessensibilizado, o paciente poderá tolerar 600 mg de aspirina e deverá manter ingesta deste fármaco indefinidamente. Estudos mostram que a administração de aspirina através do aumento gradual de doses entre 300 mg e 1.300 mg/dia após dessensibilização resultou em melhora clínica de sintomas de vias aéreas inferiores e superiores, redução nos índices de hospitalizações e atendimentos emergenciais e também redução no número de intervenções cirúrgicas nasossinusais62-64.
CONCLUSÕES
O diagnóstico de RHF requer uma abordagem cuidadosa. Testes in vitro são disponíveis para número reduzidos de fármacos e apresentam limitações quanto à sensibilidade e valores preditivos. Testes cutâneos de puntura (prick test), intradérmico e de contato são importantes ferramentas na investigação pela disponibilidade, facilidade e baixo custo. Apresentam limitações quanto à sensibilidade e valores preditivos, e necessitam de uma padronização e validação para diversos fármacos. Os testes de provocação são padrão-ouro na determinação da tolerância ou confirmação do diagnóstico, porém apresentam riscos, e devem ser realizados por profissionais experientes em centros especializados e habilitados ao atendimento de possíveis reações adversas graves. Novos testes biológicos validados são importantes na avaliação das RHF, incluindo tipagem HLA na detecção de populações susceptíveis. Estudos colaborativos multicêntricos em fisiopatologia das RHF são necessários para se compreender melhor a complexidade das doenças induzidas por exposição a fármacos, e aperfeiçoar seu manejo.
REFERÊNCIAS
1. Gomes E, Cardoso MF, Praça F, Gomes L, Mariño E, Demoly P. Self-reported drug allergy in a general adult Portuguese population. Clin Exp Allergy. 2004;34(10):1597-601.
2. Demoly P, Pichler W, Pirmohamed M, Romano A. Important questions in Allergy: 1-- drug allergy/hypersensitivity. Allergy. 2008;63(5):616-9.
3. Pirmohamed M, James S, Meakin S, Green C, Scott AK, Walley TJ, et al. Adverse drug reactions as cause of admission to hospital: prospective analysis of 18820 patients. BMJ. 2004;329(7456):15-9.
4. Bowman L, Carlstedt BC, Black CD. Incidence of adverse drug reactions in adult medical inpatients. Can J Hosp Pharm. 1994;47(5):209-16.
5. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, et al. International Consensus on drug allergy. Allergy. 2014;69(4):420-37.
6. Mirakian R, Ewan PW, Durham SR, Youlten LJ, Dugué P, Friedmann PS, et al. BSACI guidelines for the management of drug allergy. Clin Exp Allergy. 2009;39(1):43-61.
7. Gomes ER, Demoly P. Epidemiology of hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol. 2005;5(4):309-16.
8. Bircher AJ, Scherer Hofmeier K. Drug hypersensitivity reactions: Inconsistency in the use of the classification of immediate and nonimmediate reactions. J Allergy Clin Immunol. 2012;129(1):263-4; author reply 5-6.
9. Pichler WJ. Delayed drug hypersensitivity reactions. Ann Intern Med. 2003;139(8):683-93.
10. Romano A, Torres MJ, Castells M, Sanz ML, Blanca M. Diagnosis and management of drug hypersensitivity reactions. J Allergy Clin Immunol. 2011;127(3 Suppl):S67-73.
11. Demoly P, Kropf R, Bircher A, Pichler WJ. Drug hypersensitivity: questionnaire. EAACI interest group on drug hypersensitivity. Allergy. 1999;54(9):999-1003.
12. Malaman M, Rodrigues A, Felix M, Menezes U, Tanno L, Camelo-Nunes I, et al. Recomendações para o diagnóstico das reações de hipersensibilidade imediatas aos antibióticos beta-lactâmicos. Rev bras alerg imunopatol. 2011;34:257-62.
13. Brockow K, Garvey LH, Aberer W, Atanaskovic-Markovic M, Barbaud A, Bilo MB, et al. Skin test concentrations for systemically administered drugs - an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2013;68(6):702-12.
14. Romano A, Blanca M, Torres MJ, Bircher A, Aberer W, Brockow K, et al. Diagnosis of nonimmediate reactions to beta-lactam antibiotics. Allergy. 2004;59(11):1153-60.
15. Barbaud A, Reichert-Penetrat S, Tréchot P, Jacquin-Petit MA, Ehlinger A, Noirez V, et al. The use of skin testing in the investigation of cutaneous adverse drug reactions. Br J Dermatol. 1998;139(1):49-58.
16. Uyttebroek AP, Sabato V, Bridts CH, Ebo DG. In vitro diagnosis of immediate IgE-mediated drug hypersensitivity: warnings and (unmet) needs. Immunol Allergy Clin North Am. 2014;34(3):681-9, x.
17. Blanca M, Mayorga C, Torres MJ, Reche M, Moya MC, Rodriguez JL, et al. Clinical evaluation of Pharmacia CAP System RAST FEIA amoxicilloyl and benzylpenicilloyl in patients with penicillin allergy. Allergy. 2001;56(9):862-70.
18. Fontaine C, Mayorga C, Bousquet PJ, Arnoux B, Torres MJ, Blanca M, et al. Relevance of the determination of serum-specific IgE antibodies in the diagnosis of immediate beta-lactam allergy. Allergy. 2007;62(1):47-52.
19. Torres MJ, Blanca M. The complex clinical picture of beta-lactam hypersensitivity: penicillins, cephalosporins, monobactams, carbapenems, and clavams. Med Clin North Am. 2010;94(4):805-20, xii.
20. Torres MJ, Padial A, Mayorga C, Fernández T, Sanchez-Sabate E, Cornejo-García JA, et al. The diagnostic interpretation of basophil activation test in immediate allergic reactions to betalactams. Clin Exp Allergy. 2004;34(11):1768-75.
21. Uyttebroek AP, Sabato V, Faber MA, Cop N, Bridts CH, Lapeere H, et al. Basophil activation tests: time for a reconsideration. Expert Rev Clin Immunol. 2014;10(10):1325-35.
22. Ebo DG, Leysen J, Mayorga C, Rozieres A, Knol EF, Terreehorst I. The in vitro diagnosis of drug allergy: status and perspectives. Allergy. 2011;66(10):1275-86.
23. Joint Task Force on Practice Parameters; American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. Drug allergy: an updated practice parameter. Ann Allergy Asthma Immunol. 2010;105(4):259-73.
24. Aberer W, Bircher A, Romano A, Blanca M, Campi P, Fernandez J, et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions: general considerations. Allergy. 2003;58(9):854-63.
25. Thalayasingam M, Davies LJ, Llanora GV, Gerez IF, Van Bever HP, Shek LP. Clinical characteristics and outcomes of patients undergoing drug provocation tests (DPTs). Ann Acad Med Singapore. 2013;42(4):184-9.
26. Vezir E, Erkocoglu M, Civelek E, Kaya A, Azkur D, Akan A, et al. The evaluation of drug provocation tests in pediatric allergy clinic: a single center experience. Allergy Asthma Proc. 2014;35(2):156-62.
27. Messaad D, Sahla H, Benahmed S, Godard P, Bousquet J, Demoly P. Drug provocation tests in patients with a history suggesting an immediate drug hypersensitivity reaction. Ann Intern Med. 2004;140(12):1001-6.
28. Ponvert C, Perrin Y, Bados-Albiero A, Le Bourgeois M, Karila C, Delacourt C, et al. Allergy to betalactam antibiotics in children: results of a 20-year study based on clinical history, skin and challenge tests. Pediatr Allergy Immunol. 2011;22(4):411-8.
29. Agache I, Bilò M, Braunstahl GJ, Delgado L, Demoly P, Eigenmann P, et al. In vivo diagnosis of allergic diseases-allergen provocation tests. Allergy. 2015;70(4):355-65.
30. Rerkpattanapipat T, Chiriac AM, Demoly P. Drug provocation tests in hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol. 2011;11(4):299-304.
31. Ponvert C. Diagnosis of allergic and non-allergic hypersensitivity reactions to commonly used drugs and biological substances in children: diagnostic algorithm. Arch Pediatr. 2011;18(4):486-92.
32. Demoly P, Romano A, Botelho C, Bousquet-Rouanet L, Gaeta F, Silva R, et al. Determining the negative predictive value of provocation tests with beta-lactams. Allergy. 2010;65(3):327-32.
33. Defrance C, Bousquet PJ, Demoly P. Evaluating the negative predictive value of provocation tests with nonsteroidal anti-inflammatory drugs. Allergy. 2011;66(11):1410-4.
34. Mirakian R, Leech SC, Krishna MT, Richter AG, Huber PA, Farooque S, et al. Management of allergy to penicillins and other beta-lactams. Clin Exp Allergy. 2015;45(2):300-27.
35. Soriano V, Niveiro E, Fernández J, Castelló JV, González P. Successful desensitization to penicillin after diagnostic reassessment. Allergol Immunopathol (Madr). 2003;31(2):94-6.
36. Chiriac AM, Demoly P. Drug allergy diagnosis. Immunol Allergy Clin North Am. 2014;34(3):461-71,vii.
37. Cernadas JR, Brockow K, Romano A, Aberer W, Torres MJ, Bircher A, et al. General considerations on rapid desensitization for drug hypersensitivity - a consensus statement. Allergy. 2010;65(11):1357-66.
38. Hong DI, Dioun AF. Indications, protocols, and outcomes of drug desensitizations for chemotherapy and monoclonal antibodies in adults and children. J Allergy Clin Immunol Pract. 2014;2(1):13-9; quiz 20.
39. Castells M. Rapid desensitization for hypersensitivity reactions to medications. Immunol Allergy Clin North Am. 2009;29(3):585-606.
40. Scherer K, Brockow K, Aberer W, Gooi JH, Demoly P, Romano A, et al. Desensitization in delayed drug hypersensitivity reactions - an EAACI position paper of the Drug Allergy Interest Group. Allergy. 2013;68(7):844-52.
41. Solensky R. Allergy to β-lactam antibiotics. J Allergy Clin Immunol. 2012;130(6):1442-2.e5.
42. Khan DA, Solensky R. Drug allergy. J Allergy Clin Immunol. 2010;125(2 Suppl 2):S126-37.
43. Blanca M, Romano A, Torres MJ, Férnandez J, Mayorga C, Rodriguez J, et al. Update on the evaluation of hypersensitivity reactions to betalactams. Allergy. 2009;64(2):183-93.
44. Romano A, Warrington R. Antibiotic allergy. Immunol Allergy Clin North Am. 2014;34(3):489-506, vii.
45. Macy E, Ngor EW. Safely diagnosing clinically significant penicillin allergy using only penicilloyl-poly-lysine, penicillin, and oral amoxicillin. J Allergy Clin Immunol Pract. 2013;1(3):258-63.
46. Bursztejn AC, Romano A, Guéant-Rodriguez RM, Cornejo JA, Oussalah A, Chery C, et al. Allergy to betalactams and nucleotide-binding oligomerization domain (NOD) gene polymorphisms. Allergy. 2013;68(8):1076-80.
47. Mori F, Cianferoni A, Barni S, Pucci N, Rossi ME, Novembre E. Amoxicillin allergy in children: five-day drug provocation test in the diagnosis of nonimmediate reactions. J Allergy Clin Immunol Pract. 2015.
48. Cornejo-Garcia JA, Blanca-López N, Doña I, Andreu I, Agúndez JA, Carballo M, et al. Hypersensitivity reactions to non-steroidal anti-inflammatory drugs. Curr Drug Metab. 2009;10(9):971-80.
49. Kowalski ML, Asero R, Bavbek S, Blanca M, Blanca-Lopez N, Bochenek G, et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti-inflammatory drugs. Allergy. 2013;68(10):1219-32.
50. Kowalski ML, Makowska JS, Blanca M, Bavbek S, Bochenek G, Bousquet J, et al. Hypersensitivity to nonsteroidal anti-inflammatory drugs (NSAIDs) - classification, diagnosis and management: review of the EAACI/ENDA(#) and GA2LEN/HANNA*. Allergy. 2011;66(7):818-29.
51. Sánchez-Borges M. NSAID hypersensitivity (respiratory, cutaneous, and generalized anaphylactic symptoms). Med Clin North Am. 2010;94(4):853-64,xiii.
52. Canto MG, Andreu I, Fernandez J, Blanca M. Selective immediate hypersensitivity reactions to NSAIDs. Curr Opin Allergy Clin Immunol. 2009;9(4):293-7.
53. Ortega N, Doña I, Moreno E, Audicana MT, Barasona MJ, Berges-Gimeno MP, et al. Practical guidelines for diagnosing hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. J Investig Allergol Clin Immunol. 2014;24(5):308-23.
54. Torres MJ, Mayorga C, Blanca M. Nonimmediate allergic reactions induced by drugs: pathogenesis and diagnostic tests. J Investig Allergol Clin Immunol. 2009;19(2):80-90.
55. Torres MJ, Barrionuevo E, Kowalski M, Blanca M. Hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Immunol Allergy Clin North Am. 2014;34(3):507-24,vii-viii.
56. Ayuso P, Blanca-López N, Doña I, Torres MJ, Guéant-Rodríguez RM, Canto G, et al. Advanced phenotyping in hypersensitivity drug reactions to NSAIDs. Clin Exp Allergy. 2013;43(10):1097-109.
57. Himly M, Jahn-Schmid B, Pittertschatscher K, Bohle B, Grubmayr K, Ferreira F, et al. IgE-mediated immediate-type hypersensitivity to the pyrazolone drug propyphenazone. J Allergy Clin Immunol. 2003;111(4):882-8.
58. Hasan T, Jansen CT. Photopatch test reactivity: effect of photoallergen concentration and UVA dosaging. Contact Dermatitis. 1996;34(6):383-6.
59. Zedlitz S, Linzbach L, Kaufmann R, Boehncke WH. Reproducible identification of the causative drug of a fixed drug eruption by oral provocation and lesional patch testing. Contact Dermatitis. 2002;46(6):352-3.
60. Gómez E, Blanca-Lopez N, Torres MJ, Requena G, Rondon C, Canto G, et al. Immunoglobulin E-mediated immediate allergic reactions to dipyrone: value of basophil activation test in the identification of patients. Clin Exp Allergy. 2009;39(8):1217-24.
61. Nizankowska-Mogilnicka E, Bochenek G, Mastalerz L, Swierczyńska M, Picado C, Scadding G, et al. EAACI/GA2LEN guideline: aspirin provocation tests for diagnosis of aspirin hypersensitivity. Allergy. 2007;62(10):1111-8.
62. Berges-Gimeno MP, Simon RA, Stevenson DD. Long-term treatment with aspirin desensitization in asthmatic patients with aspirin-exacerbated respiratory disease. J Allergy Clin Immunol. 2003;111(1):180-6.
63. Lee JY, Simon RA, Stevenson DD. Selection of aspirin dosages for aspirin desensitization treatment in patients with aspirin-exacerbated respiratory disease. J Allergy Clin Immunol. 2007;119(1):157-64.
64. Comert S, Celebioglu E, Yucel T, Erdogan T, Karakaya G, Onerci M, et al. Aspirin 300 mg/day is effective for treating aspirin-exacerbated respiratory disease. Allergy. 2013;68(11):1443-51.