Número Atual: Janeiro-Março 2017 - Volume 1 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Vacina de Bordetella pertussis reduz IgE específica, inflamação e remodelamento num modelo animal de alergia respiratória induzida por ácaro
Bordetella pertussis vaccine reduces specific IgE, inflammation, and remodeling in an animal model of respiratory allergy caused by house dust mites
Marcelo Vivolo Aun1,2; Beatriz Mangueira Saraiva-Romanholo2; Francine Maria de Almeida2; Thayse Regina Brüggemann2; Paulo Lee Ho3; Jorge Kalil1; Milton de Arruda Martins2; Fernanda Magalhaes Arantes-Costa2; Pedro Giavina-Bianchi1
DOI: 10.5935/2526-5393.20170010
1. Serviço de Imunologia Clínica e Alergia do Hospital de Clínicas, Faculdade de Medicina da Universidade de Sao Paulo (HC-FMUSP)
2. Laboratório de Terapêutica Experimental (LIM-20), Departamento de Clínica Médica da FMUSP
3. Laboratório Especial de Inovaçao e Desenvolvimento Industrial - Instituto Butantan
Endereço para correspondência:
Marcelo Vivolo Aun
E-mail: marcelovivoloaun@gmail.com
Submetido em: 10/01/2017
Aceito em: 15/02/2017
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVO: Adjuvantes, como lipopolissacárides bacterianos, vêm sendo estudados para melhorar a eficácia da imunoterapia alérgeno-específica. A vacina de Bordetella pertussis (Pw) mostrou ter papel protetor em modelos de asma induzida por ovalbumina. Porém, seu papel na alergia a ácaros é desconhecido. Avaliamos os efeitos da vacina difteria-tétano-coqueluche (DTPw) em um modelo murino de alergia respiratória induzida por Dermatophagoides pteronyssinus (Derp).
MÉTODOS: Num protocolo de 30 dias, camundongos BALB/c foram imunizados por via subcutânea com salina ou Derp, isoladamente ou associados às vacinas de difteria-tétano (DT) ou DTPw (dias 0, 7 e 14). Posteriormente, os animais sofreram desafio intranasal diariamente com salina ou Derp (dias 22 a 28) e foram sacrificados (dia 29). Avaliamos imunoglobulinas séricas específicas, celularidade no lavado bronco-alveolar (BAL), remodelamento das vias aéreas inferiores, densidade de leucócitos polimorfonucleares (PMN) e área de muco ácido no epitélio nasal.
RESULTADOS: Os animais sensibilizados com Derp produziram altos níveis de imunoglobulinas específicas, apresentaram aumento da densidade de PMN e da área de muco ácido nasal, elevaçao da celularidade no BAL e remodelamento. As vacinas levaram à reduçao dos níveis de IgE, sendo o grupo Derp-DTPw similar aos grupos salina. Os grupos vacinados tiveram reduçao da celularidade no BAL e do remodelamento, com resultados mais expressivos no grupo Derp-DTPw em relaçao ao Derp-DT. As vacinas DT e DTPw inibiram o infiltrado PMN nasal e DTPw modulou a produçao do muco ácido.
CONCLUSOES: A vacina DTPw diminuiu a IgE específica sérica, inflamaçao nasal e pulmonar e o remodelamento das vias respiratórias inferiores.
Descritores: Asma, rinite alérgica, modelos animais, Imunoglobulina E, inflamaçao, remodelaçao das vias aéreas.
INTRODUÇAO
A imunoterapia (IT) alérgeno-específica é uma importante ferramenta no tratamento das doenças alérgicas, notadamente asma e rinite1,2. Entre os benefícios clínicos principais já demonstrados, estao a melhora dos sintomas, reduçao da necessidade de medicaçao e diminuiçao da evoluçao para asma em pacientes com rinite1,2. Os principais mecanismos imunológicos pelos quais a IT atua sao: reduçao do número e ativaçao dos mastócitos, basófilos e eosinófilos teciduais, induçao de células Treg, produtoras das citocinas moduladoras IL-10 e TGFβ, supressao de células TH2, reduçao da produçao de IgE específica e induçao da produçao de IgG4 bloqueadoras pelas células B3-6.
Os ácaros da poeira doméstica sao a principal fonte de alérgenos associados às doenças alérgicas das vias aéreas, sendo o gênero Dermatophagoides o mais frequentemente encontrado e o mais estudado em protocolos de IT7,8. A grande dificuldade de estabelecimento da IT como forma eficaz de tratamento das doenças alérgicas está no risco de eventos adversos, locais ou sistêmicos, inclusive fatais3. Assim sendo, algumas formas para tornar a IT mais eficaz e, principalmente, segura, vêm sendo testadas, como: uso de Ag recombinantes, de Ag hipoalergênicos (alergoides) ou de novos adjuvantes estimulantes de populaçoes TH1, como o monofosforil lipídeos (MPL)3,5,9.
O MPL é um derivado atóxico de lipopolissacárides (LPS) bacterianos, que tem potente poder adjuvante para vacinas, estimulando a resposta TH1 através de sua ligaçao com o receptor semelhante a Toll (TLR)-410. Já foi utilizado tanto em modelos experimentais de IT11 como em humanos12. Os trabalhos realizados até o momento, referem-se principalmente à IT com pólen12,13, entretanto, nao há estudos publicados sobre a aplicaçao de MPL em modelos de IT com ácaros da poeira.
O MPL que vem sendo produzido mais comumente é derivado da bactéria Salmonella minnesota. No Brasil, o Instituto Butantan desenvolveu o MPL a partir da bactéria Bordetella pertussis, tendo sido aplicado em modelos animais de imunizaçao como adjuvante de vacinas contra vírus Influenza, com bom perfil de eficácia e segurança14. O potencial para promover resposta imune com perfil TH1, mostrando-se eficaz como adjuvante de vacinas anti-infecciosas, levou ao interesse em analisar o papel do MPL da B. pertussis em outros tipos de vacinas, como contra
neoplasias e doenças alérgicas. Entretanto, a relaçao entre a B. pertussis, causadora da coqueluche ou tosse comprida, e a alergia respiratória ainda nao está totalmente elucidada15.
Estudos populacionais retrospectivos avaliando o impacto da infecçao por B. pertussis na sensibilizaçao e no desenvolvimento de doenças alérgicas respiratórias tiveram resultados conflitantes15-18. Nao há estudos prospectivos e os mecanismos imunopatológicos que explicariam o comportamento variado nao sao conhecidos.
As relaçoes entre a B. pertussis e o sistema imune foram muito estudadas, mas ainda nao há conclusao sobre quais seriam as reais interaçoes com relevância clínica. Embora seja conhecido o papel das células TH1 na defesa contra a B. pertussis, estudos antigos mostraram diferentes resultados em relaçao à ativaçao das subpopulaçoes de linfócitos frente à infecçao pela bactéria ou às vacinas contra esse agente. Foi demonstrado que tanto a infecçao pela B. pertussis como a imunizaçao com a vacina de pertussis celular morta por calor, chamada whole-cell pertussis (Pw), induziria uma resposta TH1, ao passo que a vacina acelular (Pa), uma resposta TH219-21.
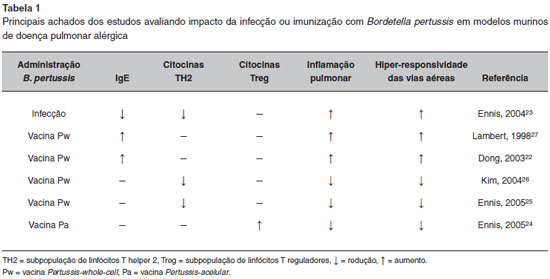
Os mecanismos dessa ativaçao imunológica mostraram-se ainda mais complexos quando foram avaliados os efeitos da infecçao pela bactéria ou de suas vacinas em modelos experimentais de alergia respiratória. Desde o início do século XXI, alguns estudos foram publicados, com diferentes desenhos experimentais e resultados variados. Tanto os desfechos sorológicos (IgE e IgG específicas), como os de inflamaçao e remodelamento nao permitiram uma conclusao sobre o possível papel protetor ou agressor das vacinas de pertussis na alergia respiratória. Os principais estudos em animais avaliando a relaçao entre alergia respiratória e o efeito da infecçao ou das vacinas de pertussis estao sumarizados na Tabela 122-27.
O estudo de melhor desenho experimental foi publicado em 2006, por Gruber et al. Foram avaliados os efeitos da vacina dupla contra difteria e tétano (DT) e da DTPw num modelo animal de alergia respiratória induzida por OVA28. Foi observado um efeito inibitório sobre a doença alérgica pelas duas vacinas, sendo que a DTPw mostrou-se superior à DT com relaçao à sensibilizaçao, inflamaçao das vias aéreas e hiper-responsividade28. Contudo, este estudo utilizou como alérgeno a OVA, que nao induz doença em humanos, o que dificulta a transposiçao desses dados para a rinite e asma alérgica humana.
No presente estudo, avaliamos os efeitos das vacinas DT e DTPw sobre a doença alérgica respiratória induzida pelo ácaro da poeira Dermatophagoides pteronyssinus num modelo experimental em camundongos, tentando definir o real papel do componente pertussis na inibiçao da alergia. A partir daí, poder-se-á estudar um novo possível adjuvante a ser usado em modelos de imunoterapia alérgeno-específica, tanto em modelos animais quanto em humanos.
MÉTODOS
Foram utilizados camundongos BALB/c machos adultos, livres de patógenos específicos, com idade de 6 a 8 semanas. Foram mantidos em biotério de manutençao sob alimentaçao e água ad libitum. Todos receberam cuidados de acordo com o "Guia de cuidados e uso de animais de Laboratório", publicado no National Institutes of Health (NIH publication 85-23, revisado em 1985), e os experimentos foram realizados sob anestesia geral. O protocolo foi aprovado pelo Comitê de Ética em Pesquisa da instituiçao (protocolo 405/11). Nao houve perdas de animais durante os 30 dias do protocolo.
Os animais foram divididos em seis grupos, com 10 camundongos em cada grupo, conforme demonstrado na Tabela 2. Os três primeiros grupos foram submetidos à aplicaçao por via subcutânea (s.c.) de soluçao salina, associada ou nao às vacinas DT ou DTPw e todos foram desafiados com salina via intranasal (i.n.). Os outros três grupos foram sensibilizados com extrato do ácaro Derp, associado ou nao às vacinas DT ou DTPw e todos foram desafiados com Derp via i.n. (Tabela 2).
O protocolo de sensibilizaçao e induçao da inflamaçao teve a duraçao de 30 dias, conforme esquematizado na Figura 1. Os animais receberam as injeçoes de salina ou do antígeno, combinadas ou nao às vacinas DT e DTPw, nos dias 0, 7 e 14. A seguir, foram submetidos às provocaçoes com instilaçoes i.n. diárias entre os dias 22 e 28. Os animais foram sacrificados para estudo no dia 29 (Figura 1), conforme estudo publicado29.
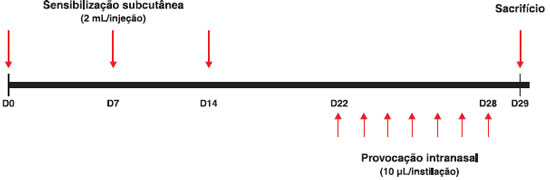
Figura 1 Esquema do protocolo de sensibilizaçao, provocaçao e sacrifício com duraçao de 30 dias (D0 a D29)
O Ag estudado foi o ácaro da poeira Dermatophagoides pteronyssinus (Derp), através de extrato em pó liofilizado (Alergia Clínica Laboratorial e Comércio Ltda., Sao Paulo, Brasil), diluído em soluçao salina sem conservante e armazenado em geladeira (4 ºC). A concentraçao dos alérgenos principais (Der p 1 e Der p 2) era de 34 µg/mg de extrato (dados fornecidos pelo fabricante).
Para a sensibilizaçao foi utilizado como adjuvante o hidróxido de alumínio (alume), na dose de 6 mg por aplicaçao. Os grupos de estudo receberam três aplicaçoes de Derp na dose de 50 µg (1,7 µg dos alérgenos principais), diluídos em salina com alume 6 mg, com intervalos de 7 dias29. Os grupos controles receberam três aplicaçoes de soluçao salina com alume 6 mg (volume total 0,2 mL), com o mesmo intervalo entre as doses (Tabela 2 e Figura 1).
Durante a etapa da sensibilizaçao, os grupos receberam as vacinas dupla infantil (DT), tríplice bacteriana (DTPw) ou soluçao salina em associaçao ao antígeno de estudo (Derp ou salina), nas mesmas injeçoes, nos dias 0, 7 e 14, via s.c., na base da cauda (Tabela 2). As vacinas foram produzidas e fornecidas pelo Instituto Butantan e armazenadas a 4 ºC. Cada animal imunizado recebeu, em cada aplicaçao, 62,5 µL da respectiva vacina, equivalente a 0,25 UI de antitoxina diftérica e tetânica nos grupos DT, além de 0,5 UI de antígeno pertussis nos grupos DTPw. Todos os grupos receberam alume na dose de 6 mg durante a sensibilizaçao e os grupos vacinados também receberam o alume usado para adsorver as vacinas.
Na etapa do desafio, os animais foram submetidos às instilaçoes via i.n. da substância de estudo dos dias 22 ao 28, diariamente, entre nove e onze horas da manha. Os grupos Sal, Sal-DT e Sal-DTPw receberam 10 µL de soluçao salina, enquanto os grupos Derp, Derp-DT e Derp-DTPw foram submetidos à administraçao i.n. de 50 µg de Derp (1,7 µg dos alérgenos principais), diluído em salina, totalizando 10 µL (Tabela 2 e Figura 1).
Vinte e quatro horas após o último desafio, os animais foram anestesiados com tiopental (70 mg/kg), traqueostomizados, exsanguinados via dissecçao da aorta abdominal, com subsequente coleta do BAL pela cânula da traqueostomia e remoçao dos pulmoes para análise histológica. O sangue coletado foi utilizado para dosagem de anticorpos específicos (IgE, IgG1 e IgG2a) por ensaio imunoenzimático (ELISA).
Após a coleta do sangue, as amostras foram imediatamente centrifugadas por 10 minutos (5 ºC; 3.000 rpm). Amostras do soro foram armazenadas a -80 ºC até o dia da realizaçao do ensaio. A dosagem de anticorpos IgE, IgG1 e IgG2a anti-Derp foi realizada pelo ensaio imunoenzimático (ELISA) indireto, conforme descriçao em publicaçao anterior29. Os resultados foram expressos como a média das absorbâncias ± erro-padrao das diluiçoes seriadas das amostras de cada grupo.
Os pulmoes foram lavados pela traqueostomia com 1,5 ml de PBS + EDTA 10 mM para coleta do fluido do BAL. O fluido do BAL coletado foi centrifugado a 800 RPM por 10 minutos, o sobrenadante foi armazenado a -20 ºC e o botao celular ressuspenso em HBSS + 0,1% BSA (bovine serum albumin) para contagem total das células em câmara de Neubauer. Alíquotas da suspensao celular foram centrifugadas em lâminas de vidro usando uma citocentrífuga e coradas com Giemsa. A contagem de 300 células foi feita em campos aleatoriamente selecionados. Para obtençao do número absoluto de cada populaçao celular no BAL, as porcentagens foram multiplicadas pelo número total de células encontradas no volume.
Após a coleta do BAL, os pulmoes foram removidos em bloco e separados, sendo o pulmao esquerdo separado para ser submetidos à análise histológica e o direito para quantificaçao de citocinas no homogenato pulmonar.
O pulmao esquerdo foi fixado com formaldeído 4% por 24 horas. O material foi cortado para posteriormente ser incluído em parafina e corado com hematoxilina-eosina (HE). As lâminas foram analisadas em microscópio óptico comum para a quantificaçao de colágeno, marcador da matriz extracelular e indicativo de remodelamento pulmonar. As lâminas foram coradas com a coloraçao de Picrosírius-Red, de modo a quantificar as fibras colágenas. A quantificaçao da proporçao de fibras colágenas foi realizada por meio de análise de imagem utilizando o software Image Pro Plus (Media Cybernetics Inc., Bethesda, Maryland, USA). Foram analisadas quatro secçoes pulmonares coradas de cada camundongo/grupo.
O pulmao direito foi removido e homogeneizado em PBS (600 µL), usando-se beads de metal, conforme recomendaçoes do fabricante (Powerlyzer, MoBio Laboratories Inc., USA). O homogenato foi armazenado a -80 ºC para posterior quantificaçao de citocinas. Os níveis de IL-4, IL-5, IL-10, TGF-β e IFN-γ nas amostras foram quantificados por ELISA (RD System, MN, USA), onde microplacas (Costar, Cambridge, MA, USA) foram sensibilizadas com anticorpos monoclonais específicos para cada citocina. Após lavagem e distribuiçao das amostras, foram adicionados anticorpos específicos para as diferentes citocinas conjugados à biotina. Para a revelaçao da ligaçao, soluçao reveladora contendo conjugado enzimático de estreptavidina-peroxidase, substrato e cromógeno, foi adicionado. A leitura da reaçao foi realizada a 450 nm em espectrofotômetro M2 (Spectramax L, Moleculas Devices). As concentraçoes das amostras foram calculadas a partir das curvas-padrao obtidas com as citocinas recombinantes.
Após a exsanguinaçao e a ressecçao dos pulmoes, a cabeça do animal foi removida, com a mandíbula desarticulada. O material foi colocado em formol tamponado por 24 horas e, depois, em soluçao com EDTA para descalcificaçao. Ao término da descalcificaçao, a cavidade nasal foi dividida por meio de secçao transversal para análise da regiao medial, com o ponto de corte próximo à papila incisiva, anteriormente ao palato duro30.
As amostras foram embebidas em parafina e processadas de acordo com a rotina histológica. Cortes de 5 µm de espessura foram obtidos ao nível da cavidade nasal estudada.
A análise morfométrica foi realizada com o auxílio de um retículo de 50 retas e 100 pontos, com área conhecida, acoplado à ocular do microscópio ótico Zeiss Axiophot (Zeiss, Oberkochen, Germany). A coloraçao com HE foi utilizada para quantificaçao de leucócitos polimorfonucleares (PMN) no epitélio nasal. A densidade foi determinada pela contagem do número de PMN presentes na mucosa nasal a partir do septo, dividido pelo número de pontos correspondendo à área total da mucosa, num aumento de 1000X. Em cada lâmina preparada com tecido de apenas um animal, três vias aéreas foram analisadas.
Para a quantificaçao do muco ácido nasal, lâminas foram coradas com ácido periódico de Schiff e azul alciano (PAS/AB), com um pH de 2,5. Por meio dessa técnica, as glicoproteínas ácidas sao coradas em azul. O conteúdo do muco ácido do epitélio respiratório da cavidade nasal foi quantificado pela mesma análise morfométrica descrita acima. A proporçao de muco ácido no epitélio respiratório foi determinado por contagem de pontos nesta área, dividido pela contagem total de pontos no epitélio.
As análises estatísticas foram realizadas através do programa SigmaStat 10.0 (Jandel, Calif., USA). A comparaçao entre os grupos foi feita com análise do teste t de Student para os dados paramétricos e Mann-Whitney para a comparaçao de dados nao paramétricos. Foi considerado significante p menor que 0,05.
RESULTADOS
Os níveis de IgE específica foram superiores nos grupos Derp e Derp-DT em relaçao aos demais grupos, conforme mostrado na Figura 2. O grupo Derp-DTPw teve níveis semelhantes aos grupos sensibilizados com salina. O grupo controle positivo (Derp) teve níveis mais elevados do que o grupo vacinado com dupla infantil (Derp-DT) e tríplice bacteriana (Derp-DTPw), este último com IgE específica inferior ao Derp-DT (Figura 2A).
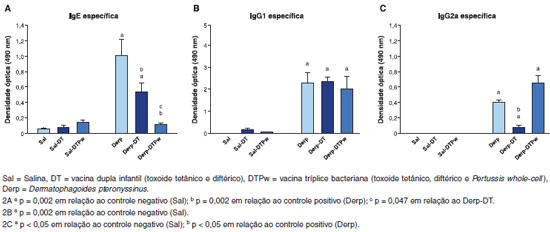
Figura 2 Dosagens da IgE específica sérica anti-Derp (2A), IgG1 específica (2B) e IgG2a específica (2C) por ensaio imunoenzimático (ELISA), através da medida da densidade óptica (OD), em nm
Os três grupos sensibilizados com o ácaro apresentaram níveis detectáveis de IgG1 específica, sem diferença entre eles (Figura 2B). Com relaçao à IgG2a específica, os três grupos sensibilizados com Derp apresentaram níveis detectáveis, conforme apresentado na Figura 2C. O grupo submetido ao ácaro com vacina dupla infantil (Derp-DT) teve níveis de IgG2a inferiores ao grupo controle positivo (Derp). Nao houve diferença entre os grupos Derp e Derp-DTPw (p=0,18) (Figura 2C).
Houve um aumento da celularidade total nos grupos submetidos ao ácaro isoladamente e em associaçao à vacina dupla infantil (Derp e Derp-DT), conforme apresentado na Figura 3A. A vacina DT levou à reduçao da celularidade em relaçao ao grupo Derp. O grupo Derp-DTPw teve contagem total de células menor que os grupos Derp e Derp-DT e similar à dos grupos sensibilizados com salina (Figura 3A). Houve um aumento da contagem de macrófagos nos grupos Derp e Derp-DT em relaçao ao grupo salina, conforme apresentado na Figura 3B. O grupo Derp-DTPw teve contagem total de células menor que os grupos Derp e Derp-DT e similar à dos grupos sensibilizados com salina (Figura 3B). Quanto à contagem de linfócitos, apenas o grupo controle positivo (Derp) teve nível superior ao controle negativo (Sal), conforme demonstrado na Figura 3C. Os níveis de neutrófilos e eosinófilos no BAL nao foram diferentes entre os seis grupos de estudo (dados nao mostrados).
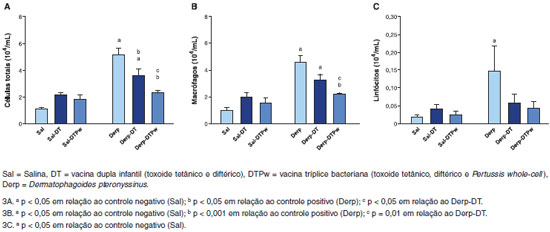
Figura 3 Celularidade total (3A), contagem de macrófagos (3B) e linfócitos (3C) no lavado-broncoalveolar (BAL) em 104 células/mL
Com relaçao ao remodelamento das vias aéreas inferiores, o grupo sensibilizado apenas com ácaro (Derp) teve maior área de colágeno do que o controle negativo (Sal), conforme apresentado na Figura 4. Os grupos sensibilizados com salina e que receberam uma das vacinas, DT ou DTPw, tiveram reduçao da área de colágeno em relaçao ao controle negativo. Além disso, entre os três grupos sensibilizados com Derp, houve uma reduçao gradativa da área de colágeno de acordo com a cobertura vacinal. O grupo Derp-DT teve menor deposiçao de colágeno do que o grupo Derp e, por sua vez, o grupo Derp-DTPw teve deposiçao ainda menor (Figura 4).
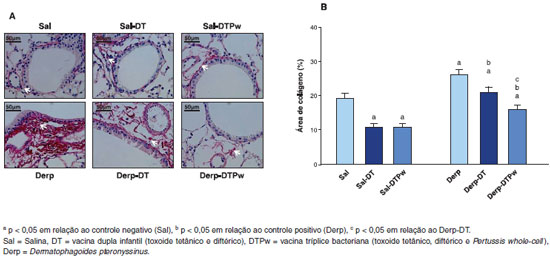
Figura 4 Colágeno na regiao peribroncovascular assinalado com setas brancas. Nota-se um predomínio no grupo Derp em relaçao aos demais grupos (Picrosírius, aumento 400x) (4A) e área de colágeno peribroncovascular em % (coloraçao Picrosírius) (4B)
Nao foi possível encontrar níveis detectáveis das citocinas IL-4, IL-5, IL-10 e IFN-γ no homogenato pulmonar (dados nao mostrados). Houve incremento do TGF-β apenas no grupo Derp em comparaçao ao Sal e ambas as vacinas levaram à reduçao dos níveis dessa citocina, sem diferença entre elas (Figura 5).
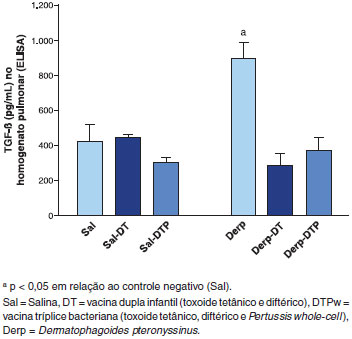
Figura 5 Dosagem de Fator de transformaçao de crescimento crescimento β (TGF-β) no homogenato pulmonar por ensaio imunoenzimático (ELISA) em pg/mL
Em relaçao às vias aéreas superiores, houve aumento do infiltrado inflamatório às custas de leucócitos polimorfonucleares (PMN) no epitélio nasal no grupo Derp em relaçao aos grupos salina, conforme demonstrado na Figura 6. Essa elevaçao foi inibida pelas vacinas DT e DTPw, sendo que o grupo Derp-DT teve níveis inferiores aos grupos Derp e Derp-DTPw (Figura 6).
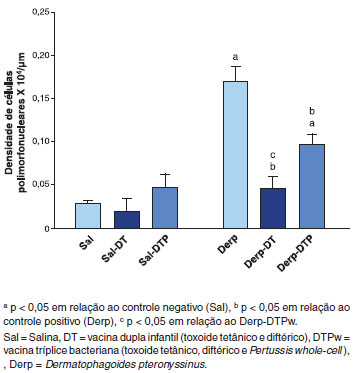
Figura 6 Densidade de leucócitos polimorfonucleares (PMN) no epitélio nasal em 104 células/µm (hematoxilina-eosina)
Já a área de muco no epitélio nasal foi maior no grupo Derp e Derp-DT em relaçao aos controles (Figura 7). A vacina DTPw reduziu essa área para níveis inferiores aos grupos Derp e Derp-DT, alcançando níveis semelhantes ao grupo Sal (Figura 7).
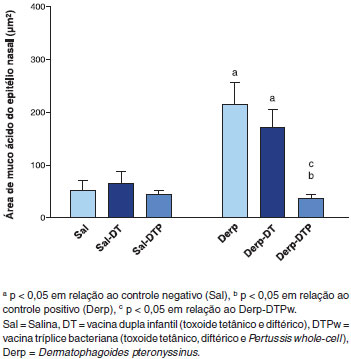
Figura 7 Area de muco ácido do epitélio nasal, medida em µm2 (periódico de Schiff e azul alciano - PAS/AB)
DISCUSSAO
O presente estudo é o primeiro a utilizar a combinaçao das vacinas disponíveis comercialmente, a dupla infantil contra difteria e tétano (DT) e a tríplice bacteriana contra difteria, tétano e coqueluche (pertussis whole-cell - DTPw), com o ácaro da poeira Dermatophagoides pteronyssinus (Derp) em um modelo experimental de doença respiratória alérgica crônica.
Até o presente momento, apenas um estudo havia avaliado a relaçao entre doença respiratória alérgica por ácaro (D. farinae) e imunizaçao com pertussis inativada num modelo em ratos22. Dong et al. aplicaram a bactéria inativada pelas vias intraperitoneal ou intratraqueal, o que levou a um agravamento da inflamaçao pulmonar e aumento dos níveis de IgE e IgG específicas no BAL dos grupos que receberam pertussis como adjuvante22. Porém, nao houve diferença nos níveis de Ig séricas entre os grupos que receberam ou nao a vacina.
Estudos preliminares levavam a crer que a B. pertussis induziria tanto uma resposta TH1 como TH2, com grande produçao de IgE, o que nao foi confirmado em trabalhos mais recentes de melhor desenho experimental19,31. Em 2004, Kim et al. demonstraram que, num modelo de doença alérgica induzida por OVA, a vacina Pw levou a uma diminuiçao da inflamaçao pulmonar, do infiltrado eosinofílico e da hiper-responsividade das vias aéreas, com reduçao das citocinas TH2, IL-4 e IL-5, sem incremento de IL-2 e IFN-γ 26. Em nosso experimento, mostramos que houve reduçao da IgE específica, da inflamaçao nasal e pulmonar, bem como do remodelamento e dos níveis de TGF-β nos animais vacinados com Pw.
Alguns achados do presente estudo sao inéditos e relevantes. Inicialmente, nao era conhecido o perfil de segurança da associaçao entre as vacinas DT e DTPw ao extrato liofilizado de Derp por via subcutânea. Tal esquema mostrou-se seguro neste modelo experimental, já que nao houve nenhum óbito ou evento adverso maior nos animais que receberam as vacinas, tanto isoladamente como em conjunto com Derp.
Ainda de forma destacada, mostramos que os dois esquemas vacinais podem ter papel protetor na doença atópica respiratória. Apenas o estudo de Gruber et al., publicado em 2006, havia avaliado o impacto dessas duas vacinas em modelos de doença respiratória alérgica28. Nele, comparou-se o efeito das duas vacinas num modelo de alergia induzido por OVA, e houve papel protetor, particularmente da tríplice bacteriana, com um desvio da resposta TH2 para TH128.
Nossos dados mostraram que as vacinas DT e DTPw inibiram a resposta inflamatória alérgica. Houve diminuiçao da IgE específica anti-Derp nos animais vacinados com DT, o que foi ainda mais evidente no grupo DTPw, mostrando um papel adjuvante da pertussis na modulaçao da resposta TH2 (Figura 2).
Por outro lado, o modelo experimental desenvolvido por nós e utilizado neste estudo nao foi capaz de induzir uma resposta inflamatória eosinofílica (dados nao mostrados). Em estudo previamente publicado por nosso grupo29, no qual fizemos uma avaliaçao da dose-resposta (50 versus 500 µg de Derp por aplicaçao) e definimos a via s.c. como superior à i.p., houve um infiltrado eosinofílico significante nos animais sensibilizados e desafiados com Derp29. Como nao conseguimos replicar essa inflamaçao nos animais definidos como controles positivos (grupo Derp), ficou inviável analisar o efeito das vacinas na eosinofilia do trato respiratório inferior.
O que observamos no presente estudo foi a ocorrência de uma resposta inflamatória celular, às custas principalmente de macrófagos e também de linfócitos (Figura 3). A vacina DTPw foi capaz de inibir o influxo de macrófagos nas vias aéreas inferiores (Figura 3B). Lee et al. demonstraram que macrófagos alveolares têm participaçao na inflamaçao de perfil TH2 e esse processo é reduzido em modelos animais que utilizam linhagens knock-out para essas células32. Além disso, a linhagem de macrófagos M2, particularmente, parece ter influência na regulaçao de doenças inflamatórias nao-infecciosas, inclusive induzindo o remodelamento33. Contudo, os mecanismos pelos quais os macrófagos participam da perpetuaçao da inflamaçao e da induçao do remodelamento na asma ainda nao sao conhecidos.
Levando-se em consideraçao o princípio das "Vias Aéreas Unidas", utilizamos neste modelo a via i.n. para desafio com o Ag e analisamos dois desfechos de inflamaçao nas vias aéreas superiores. Tanto o infiltrado inflamatório, às custas de PMN, como a área de muco ácido no epitélio nasal foram elevados no grupo Derp, mostrando que o modelo foi eficiente na induçao de rinite. Isso permitiu que confirmássemos, mais uma vez, o papel imunomodulador de Pw. A vacina reduziu a inflamaçao PMN e a área de muco ácido (Figuras 6 e 7). Embora o efeito da vacina dupla infantil no infiltrado PMN nasal tenha sido superior ao da tríplice, apenas a vacina que continha Pw levou à reduçao do muco ácido, trazendo-o a níveis similares aos do grupo salina (Figura 7).
Talvez o achado mais importante do nosso estudo tenha sido o do remodelamento das vias aéreas inferiores. Embora nao tenhamos conseguido induzir inflamaçao eosinofílica pulmonar e encontrar citocinas de perfil TH2 no tecido pulmonar, detectamos aumento da deposiçao de colágeno nesse tecido. Como apresentado na Figura 4, o grupo Derp apresentou aumento da área de colágeno em relaçao ao grupo salina e esse efeito foi minimizado por DT e DTPw. Nao encontramos nenhum estudo anterior de tais vacinas em modelos de alergia respiratória que incluíram o desfecho remodelamento.
A ocorrência de remodelamento das vias aéreas inferiores na ausência de eosinofilia ainda nao foi descrita na literatura. Braunstahl et al. estudaram pacientes com rinite, com ou sem asma, e controles saudáveis, e confirmaram que ocorre remodelamento das vias aéreas inferiores nos pacientes com rinite, mesmo sem asma34. Entretanto, também havia níveis mais elevados de eosinófilos no epitélio brônquico deste grupo em relaçao aos controles normais61. Nosso estudo se mostrou pioneiro em documentar remodelamento das vias aéreas inferiores, independentemente da presença de citocinas TH2 e dos eosinófilos. Nao sabemos, contudo, até que ponto os macrófagos e linfócitos encontrados no BAL participaram desse processo. A única citocina quantificável no homogenato pulmonar foi o TGF-β, tradicionalmente associado ao processo de remodelamento35,36. O grupo controle positivo, Derp, teve níveis superiores de TGF-β em relaçao ao grupo salina, e as duas vacinas modularam esse efeito (Figura 5). É possível que o TGF-β tenha sido a citocina implicada no remodelamento encontrado em nossos animais. Contudo, dada a impossibilidade de dosar as demais citocinas pelo método empregado, nao foi possível descrever o mecanismo envolvido em todo esse processo.
Demonstramos que as duas vacinas foram capazes de reduzir o remodelamento do tecido pulmonar dos animais em comparaçao a seus respectivos controles. Pode-se notar que, nos animais sensibilizados e desafiados com o ácaro, o componente Pw levou a uma proteçao adicional, sugerindo realmente um papel de modulaçao da resposta imune.
A independência da presença do eosinófilo como célula de destaque na inflamaçao foi outro dado interessante de nosso estudo. Embora nao tenhamos conseguido induzir um infiltrado eosinofílico significativo com este modelo, o depósito de fibras colágenas, configurando o remodelamento no tecido pulmonar, ocorreu de forma proeminente. O eosinófilo é descrito como o principal responsável pelo dano tecidual crônico e pelo remodelamento das vias aéreas na asma, mas sua real açao patogênica ainda nao está elucidada37.
Em 2011, Fattouh et al. utilizaram duas formas de minimizar a presença do eosinófilo nas vias aéreas de camundongos num modelo de doença alérgica induzida por ácaro38. Os autores administraram o anticorpo anti-CCR3, que depleta seletivamente os eosinófilos, e usaram também duas linhagens de camundongos deficientes nessas células, ΔdblGATA e a linhagem transgênica PHIL, de modo a investigar o real papel do eosinófilo na patogênese da sensibilizaçao, inflamaçao e remodelamento38. Foi demonstrado que, mesmo nos animais depletados de eosinófilos, houve resposta IgE-mediada, inflamaçao TH2, hiper-responsividade e remodelamento, por vezes similar à dos animais nao depletados, sugerindo uma importância menor dessas células do que antes imaginado38. Nossos dados corroboram esses achados e sugerem a necessidade de se aprofundarem as pesquisas sobre a verdadeira importância dos eosinófilos na patogênese da doença alérgica.
Nosso estudo apresenta algumas limitaçoes. Em primeiro lugar, pelo fato de nao ocorrer eosinofilia pulmonar nos animais sensibilizados com Derp. Além disso, nao foi possível encontrar níveis detectáveis das principais citocinas de perfil TH1, TH2 e da IL-10 no homogenato pulmonar, o que dificulta a compreensao dos mecanismos imunopatológicos envolvidos na gênese da doença e na modulaçao pelas vacinas estudadas.
Entendemos que o Ag aplicado via s.c. na primeira etapa foi eficaz na induçao da sensibilizaçao, pois ocorreu formaçao de IgE, IgG1 e IgG2a específicas (Figura 2). No entanto, acreditamos que o ácaro aplicado por via i.n. na segunda etapa (desafio), com os animais acordados (nao anestesiados), nao atingiu à via aérea inferior. Caso o Ag tivesse alcançado a árvore brônquica, todo o processo patológico que compoe a asma alérgica (eosinofilia, citocinas TH2, hiper-responsividade e remodelamento) teria sido completo.
Southam et al., em 200239, e Siddiqui et al., em 200840, já haviam demonstrado que o desafio pela via i.n. sem uso de anestesia leva à menor deposiçao da substância no trato respiratório inferior. Assim, como nossos animais nao foram anestesiados para o desafio, é provável que parte do extrato administrado i.n. nao tenha atingido os pulmoes. Com isso, apenas a parte realmente inalada e o componente "Vias Aéreas Unidas" justificaria o achado de aumento de mononucleares no BAL e remodelamento pulmonar. O uso de anestésico em baixa dose durante o desafio ou mesmo a aplicaçao do alérgeno por via i.t. teria corrigido essas dificuldades.
As vacinas dupla adulto (DT) e tríplice bacteriana (DTPw) mostraram-se seguras quando administradas em associaçao ao extrato liofilizado de D. pteronyssinus por via s.c. As duas estratégias levaram à diminuiçao da sensibilizaçao alérgica, da inflamaçao nasal e pulmonar e do remodelamento das vias aéreas inferiores neste modelo experimental de doença respiratória alérgica crônica induzida por ácaro, sendo que o componente Pw foi associado a todos esses desfechos.
O presente estudo pode ser útil na melhor compreensao da relaçao entre imunizaçao anti-infecciosa e doença alérgica, bem como no melhor entendimento da relaçao entre a bactéria B. pertussis, sua vacina Pw e a alergia respiratória. Estudos futuros nessa linha de pesquisa podem levar ao desenvolvimento de novos adjuvantes bacterianos para IT alérgeno-específica.
AGRADECIMENTOS
As colegas Thayse Regina Bruggemann e Isabella Genaro, que colaboraram em alguns experimentos e análises de dados. Aos demais funcionários do laboratório e aos animais utilizados no estudo, que permitiram a conclusao do mesmo.
REFERENCIAS
1. Cox L, Nelson H, Lockey R, Calabria C, Chacko T, Finegold I, et al. Allergen immunotherapy: A practice parameter third update. J Allergy Clin Immunol. 2011;127:S1-55.
2. Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W, et al. International consensus on allergy immunotherapy. J Allergy Clin Immunol. 2015;136:556-68.
3. Casale TB, Stokes JR. Immunotherapy: What lies beyond. J Allergy Clin Immunol. 2014;133:612-9.
4. Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy. J Allergy Clin Immunol. 2007;119:780-9.
5. Frew AJ. Allergen immunotherapy. J Allergy Clin Immunol. 2010;125:S306-S13.
6. Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy: Multiple suppressor factors at work in immune tolerance to allergens. J Allergy Clin Immunol. 2014;133:621-31.
7. Gandhi VD, Davidson C, Asaduzzaman M, Nahirney D, Vliagoftis H. House Dust Mite Interactions with Airway Epithelium: Role in Allergic Airway Inflammation. Curr Allergy Asthma Rep. 2013;13:262-70.
8. Cui YB. Structural biology of mite allergens. Mol Biol Rep. 2013;40:681-6.
9. Nagata M, Nakagome K. Allergen immunotherapy in asthma: current status and future perspectives. Allergol Int. 2010;59:15-9.
10. Evans JT, Cluff CW, Johnson DA, Lacy MJ, Persing DH, Baldridge JR. Enhancement of antigen-specific immunity via the TLR4 ligands MPL adjuvant and Ribi.529. Expert Rev Vaccines. 2003;2:219-29.
11. Wheeler AW, Marshall JS, Ulrich JT. A Th1-inducing adjuvant, MPL (R), enhances antibody profiles in experimental animals suggesting it has the potential to improve the efficacy of allergy vaccines. Int Arch Allergy Immunol. 2001;126:135-9.
12. Drachenberg KJ, Wheeler AW, Stuebner P, Horak F. A well-tolerated grass pollen-specific allergy vaccine containing a novel adjuvant, monophosphoryl lipid A, reduces allergic symptoms after only four preseasonal injections. Allergy. 2001;56:498-505.
13. Drachenberg KJ, Heinzkill M, Urban E, Woroniecki SR. Efficacy and tolerability of short-term specific immunotherapy with pollen allergoids adjuvanted by monophosphoryl lipid A (MPL) for children and adolescents. Allergol Immunopathol. 2003;31:270-7.
14. Quintilio W, Kubrusly FS, Iourtov D, Miyaki C, Sakauchi MA, Lucio F, et al. Bordetella pertussis monophosphoryl lipid A as adjuvant for inactivated split virion influenza vaccine in mice. Vaccine. 2009;27:4219-24.
15. Capili CR, Hettinger A, Rigelman-Hedberg N, Fink L, Boyce T, Lahr B, et al. Increased risk of pertussis in patients with asthma. J Allergy Clin Immunol. 2012;129:957-63.
16. Kendirli SG, Yilmaz M, Bayram I, Altintas DU, Inal A, Karakoc G. Potential association between allergic diseases and pertussis infection in schoolchildren: Results of two cross-sectional studies seven years apart. Allergol Immunopathol. 2009;37:21-5.
17. Blanco-Quiros A, Garcia-Marcos L, Garrote JA, Martinez-Torres AE, Leon A. Antibody levels to Bordetella pertussis in 10-yr-old children with atopy and atopic asthma. Pediatr Allergy Immunol. 2005;16:637-40.
18. Wjst M, Dold S, Reitmeir P, Fritzsch C, Vonmutius E, Thiemann HH. Pertussis infection and allergic sensitization. Ann Allergy. 1994;73:450-4.
19. Redhead K, Watkins J, Barnard A, Mills KHG. Effective immunization against Bordetella pertussis respiratory infection in mice is dependent on induction of cell-mediated immunity. Infect Immun. 1993;61:3190-8.
20. Barnard A, Mahon BP, Watkins J, Redhead K, Mills KHG. Th1/Th2 cell dichotomy in acquired immunity to Bordetella pertussis: Variables in the in vivo priming and in vitro cytokine detection techniques affect the classification of T-cell subsets as Th1, Th2 or Th0. Immunology. 1996;87:372-80.
21. Ryan M, Gothefors L, Storsaeter J, Mills KHG. Bordetella pertussis-specific Th1/Th2 cells generated following respiratory infection or immunization with an acellular vaccine: Comparison of the T cell cytokine profiles in infants and mice. Pertussis Vaccine Trials. 1997;89:297-305.
22. Dong W, Selgrade MK, Gilmour MI. Systemic administration of Bordetella pertussis enhances pulmonary sensitization to house dust mite in juvenile rats. Toxicol Sci. 2003;72:113-21.
23. Ennis DP, Cassidy JP, Mahon BP. Prior Bordetella pertussis infection modulates allergen priming and the severity of airway pathology in a murine model of allergic asthma. Clin Exp Allergy. 2004;34:1488-97.
24. Ennis DP, Cassidy JP, Mahon BP. Acellular pertussis vaccine protects against exacerbation of allergic asthma due to Bordetella pertussis in a murine model. Clin Diagn Lab Immunol. 2005;12:409-17.
25. Ennis DP, Cassidy JP, Mahon BP. Whole-cell pertussis vaccine protects against Bordetella pertussis exacerbation of allergic asthma. Immunol Lett. 2005;97:91-100.
26. Kim YS, Kwon KS, Kim DK, Choi IW, Lee HK. Inhibition of murine allergic airway disease by Bordetella pertussis. Immunology. 2004;112:624-30.
27. Gruber C, Gerhold K, von Stuckrad SL, Avagyan A, Quarcoo D, Ahrens B, et al. Common vaccine antigens inhibit allergen-induced sensitization and airway hyperresponsiveness in a murine model. Allergy. 2006;61:820-7.
28. Lambert AL, Winsett DW, Costa DL, Selgrade MK, Gilmour MI. Transfer of allergic airway responses with serum and lymphocytes from rats sensitized to dust mite. Am J Respir Crit Care Med. 1998;157:1991-9.
29. Aun MV, Saraiva-Romanholo BM, de Almeida FM, Brüggemann TR, Kalil J, Martins M de A et al.Sensitization by subcutaneous route is superior to intraperitoneal route in induction of asthma by house dust mite in a murine model. Einstein (Sao Paulo). 2015;13:560-6.
30. Yoshizaki K, Macchione M. Effects of the participation of steroid-like compounds from air pollution in the air epithelium of male and female mice.: University of Sao Paulo School of Medicine; 2014.
31. Pauwels R, Vanderstraeten M, Platteau B, Bazin H. The non-specific enhancement of allergy. In vivo effects of Bordetella pertussis vaccine on IgE synthesis. Allergy. 1983;38:239-46.
32. Lee YG, Jeong JJ, Nyenhuis S, Berdyshev E, Chung S, Ranjan R, et al. Recruited Alveolar Macrophages, in Response to Airway Epithelial-Derived Monocyte Chemoattractant Protein 1/CCL2, Regulate Airway Inflammation and Remodeling in Allergic Asthma. Am J Respir Cell Mol Biol. 2015;52:772-84.
33. Liu YC, Zou XB, Chai YF, Yao YM. Macrophage Polarization in Inflammatory Diseases. Int J Biol Sci. 2014;10:520-9.
34. Braunstahl GJ, Fokkens WJ, Overbeek SE, KleinJan A, Hoogsteden HC, Prins JB. Mucosal and systemic inflammatory changes in allergic rhinitis and asthma: a comparison between upper and lower airways. Clin Exp Allergy. 2003;33:579-87.
35. Halwani R, Al-Muhsen S, Al-Jahdali H, Hamid Q. Role of Transforming Growth Factor-beta in Airway Remodeling in Asthma. Am J Respir Cell Mol Biol. 2011;44:127-33.
36. Yang Y, Zhang N, Lan F, Van Crombruggen K, Fang L, Hu G, et al. Transforming growth factor-beta 1 pathways in inflammatory airway diseases. Allergy. 2014;69:699-707
37. Jacobsen EA, Lee NA, Lee JJ. Re-defining the unique roles for eosinophils in allergic respiratory inflammation. Clin Exp Allergy. 2014;44:1119-36.
38. Fattouh R, Al-Garawi A, Fattouh M, Arias K, Walker TD, Goncharova S, et al. Eosinophils Are Dispensable for Allergic Remodeling and Immunity in a Model of House Dust Mite-induced Airway Disease. Am J Respir Crit Care Med. 2011;183:179-88.
39. Southam DS, Dolovich M, O'Bryne PM, Inman MD. Distribution of intranasal instillations in mice: effects of volume, time, body position, and anesthesia. Am J Physiol Lung Cell Mol Physiol. 2002;282:L833-9.
40. Siddiqui S, Morris J, Avery N, Wyand S, Rood D, Silbart LK. Pulmonary eosinophilia correlates with allergen deposition to the lower respiratory tract in a mouse model of asthma. Clin Exp Allergy. 2008;38:1381-90.
Este trabalho foi agraciado com o Prêmio Antônio Oliveira Lima de 2016 (melhor trabalho na categoria Pesquisa em Imunologia Básica e Clínica) durante o XLIII Congresso Brasileiro de Alergia e Imunologia.