Número Atual: Janeiro-Março 2017 - Volume 1 - Número 1
CARTA AO EDITOR
Teste de provocação nasal com alérgenos inalantes: da pesquisa para a prática clínica
Francisco M. Vieira, MD
DOI: 10.5935/2526-5393.20170015
Endereço para correspondência:
E-mail: famvieira@hotmail.com
Nao foram declarados conflitos de interesse associados à publicaçao desta carta
Prezado Editor,
O diagnóstico de rinite é clinico e o da etiologia alérgica está tipicamente baseado no resultado de dois testes: o teste de punctura (prick test) e a dosagem da igE específica para alérgenos inalantes no soro do paciente. A rinite alérgica (RA) tem sido classificada, basicamente, como perene e estacional, sendo que esta última ocorre durante uma estaçao polínica. A perene está principalmente associada a ácaros do pó domiciliar, a esporos de fungos e ao epitélio de animais. Entretanto, em muitas ocasioes, nao há correlaçao entre estado de sensibilizaçao e a clínica apresentada pelo paciente. Em indivíduos polissensibilizados é difícil determinar a relevância clínica da sensibilizaçao e, por outro lado, na rinite local, os métodos tradicionais nao identificam os alérgenos sensibilizantes. Muitos pacientes poderiam ser mal diagnosticados e potencialmente dessensibilizados desnecessariamente, quando o diagnóstico é obtido apenas através de testes cutâneos ou pela determinaçao da igE específica1.
O teste de provocaçao nasal (TPN) constitui na colocaçao do alérgeno perene ou polínico a ser testado na mucosa nasal, ao nível das conchas inferiores, produzindo uma resposta imediata e uma tardia conforme ocorre na RA. A histamina liberada pelos mastócitos exerce um importante papel na fase imediata e algum grau de obstruçao nasal. Essa reaçao ocorre nos primeiros 15 minutos, após a provocaçao com o antígeno e persiste por algumas horas2. Os mediadores liberados pela infiltraçao de eosinófilos estao primariamente envolvidos na reaçao da fase tardia, que ocorre horas após a exposiçao do antígeno e induz à congestao nasal3. Contudo, é difícil avaliar as duas fases separadamente em pacientes, que, diariamente, podem ser expostos a diferentes alérgenos1.
No sul do Brasil, a polissensibilizaçao por ácaros associada a polens de gramíneas pode ser frequente em pacientes com rinite e/ou rinoconjuntivite sem sintomatologia estacional característica. Isso foi observado quando foram revisados os prontuários de 1.340 indivíduos com RA, sendo que 200 (13%) possuíam essas características, sendo possíveis candidatos a TPN. Fato semelhante poderá acontecer com múltiplos alérgenos perenes, que sao considerados prevalentes em outras grandes regioes do Brasil.
O TPN, afora no diagnóstico de RA, tem sido realizado na pesquisa da fisiopatologia da RA e para investigar novos alérgenos para a imunoterapia. Atualmente, outra interessante situaçao é o uso do TPN para a denominada rinite alérgica local (RAL), muitas vezes chamada de idiopática. Nessa, pode haver uma resposta nasal localizada, com ausência de atopia sistêmica, caracterizada por uma produçao local de IgEs específicas. Associa-se uma resposta imune de padrao TH2, com infiltraçao celular durante a exposiçao natural aos alérgenos e uma resposta positiva ao TPN, com liberaçao de medidores inflamatórios tais como triptase e proteína catiônica eosinofílica5.
A associaçao de conceitos atuais permite especular, em nosso meio, do TPN ser uma nova ferramenta diagnóstica acessível, a qual poderá ser inserida na prática clínica. Contudo, os critérios para avaliaçao de uma resposta positiva e os métodos de liberaçao de alérgenos nao têm sido padronizados4. A metodologia para TPN, geralmente, está relacionada a um teste objetivo de medir a obstruçao nasal, considerando-se aqui a sua positividade. O TPN pode consumir tempo e seu uso na prática clínica pode ser limitado. Entretanto um teste de TPN rápido (TPNr) pode ser considerado atualmente, com avaliaçao nos primeiros 15 minutos, sem o uso de rinomanometria. O TPNr mostrou-se ser altamente específico, rápido e seguro para confirmar a alergia à ácaro, usando unicamente a soma dos sintomas observados1.
Concidentemente, temos utilizado essa metodologia de TPNr para polens e ácaros durante anos na prática clinica, o qual praticamos de forma aleatória, em casos selecionados de difícil diagnóstico. Outrossim, temos reduzido, ou mesmo desvinculado, o uso da medida de obstruçao nasal, substituindo-a pelo pico de fluxo inspiratório nasal. A dose para o início do TPN pode ser calculada a partir do resultado obtido no teste de punctura, utilizando-se o mesmo extrato alergênico, mas pode variar nos diferentes protocolos. Alguns autores propoem a concentraçao necessária para produzir uma pápula de 3 mm, ou 1/100 da concentraçao do extrato do teste de punctura. O TPN, usando alérgenos biologicamente padronizados, pode ser iniciado com uma concentaçao de 1/1.000 da soluçao do teste punctura e aumentado por um fator 10 sucessivamente6. Alguns centros preferem uma simples dose de alérgenos, enquanto outros preferem a titulaçao.
É usual, na maioria das vezes em nossa clínica, excluindo os asmáticos, usar-se a concentraçao de 1/100 (vol/vol) ou 1/10 (vol/vol) da soluçao do teste de punctura, seguindo alguns critérios básicos simplificados e enumerados a seguir.
1. Respeitar um período de sete dias sem o uso de anti-histamínicos, corticosteroide intranasal ou outros medicamentos que possam interferir nos resultados.
2. Ambas as fossas nasais devem ser examinadas previamente, através de rinoscopia anterior, para verificar a presença de muco ou obstruçao anatômica.
3. Uma soluçao salina ou outra contendo ClNa a 0,9%, fenol a 0,45%, pH 5,50 com glicerina a 5% (preparada em laboratório por farmacêutico), deve servir como controle negativo.
4. O spray nasal está sendo preferido, porque é capaz de liberar o antígeno na concha nasal inferior com grande deposiçao.
5. O volume a ser usado deve ser, aproximadamente, de 0,1 mL em cada fossa nasal. O paciente é instruído a realizar previamente uma breve inspiraçao profunda, além de leve compressao no local, a fim de nao haver propagaçao para a orofaringe.
6. As soluçoes devem ser mantidas em refrigeraçao (2 °C a 8 °C), e os dispositivos intercambiáveis do nebulizador que entram em contato com a mucosa esterilizados.
7. A escala de sintomas deve ser avaliada nos primeiros 5 e 15 minutos, recebendo uma pontuaçao que pode variar.
8. Particularmente, ministramos aos pacientes (adultos) sintomáticos uma dose de anti-histamínico de segunda geraçao, junto com 20-40 mg de prednisolona, mais dois jatos de corticosteroide spray em ambas fossas nasal, associada ou nao a um vasoconstritor tópico, para evitar uma possível reaçao tardia.
9. Uma história anterior de asma brônquica nao exclui a realizaçao do TPN; entretanto, o paciente deverá possuir medida do VEF1 (volume expiratório forçado no primeiro segundo) ou do Pico de Fluxo Expiratório (peak flow) superior a 70% do previsto, controlado prévia e posteriormente ao teste.
10. Todos os pacientes ou seus representantes legais devem assinar um termo de consentimento informado.
O TPNr possui uma sensibilidade e especificidade de 83,7% e 100%, respectivamente.
Essa nova metodologia parece ser mais rápida: média em minutos (22±8), que a "clássica" TPN (97±20)1.
A escala dos sintomas propostos por Lebel baseia-se na gravidade, e os pontos sao distribuídos como demonstrado na Figura 17.
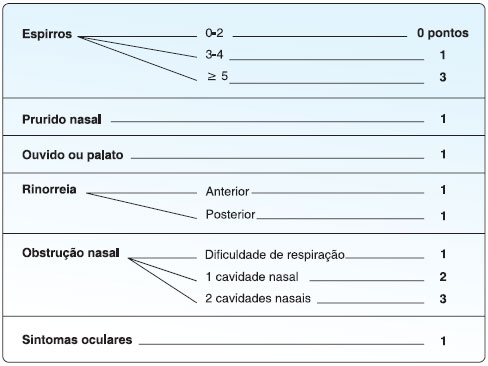
Figura 1 Escala dos sintomas propostos por Lebel7
O teste será considerado positivo se a pontuaçao for ≥ 5 (máximo possível 11 pontos).
Provavelmente, ainda por algum tempo, tenha-se dificuldade em transportar para a prática aquilo que foi aprendido durante anos na literatura médica, na qual o TPN estaria reservado exclusivamente aos ambientes de pesquisa por ser uma "técnica dificultosa e fora do alcance dos clínicos".
REFERENCIAS
1. de Blay F, Doyen V, Lutz C, Godet J, Barning C, Qi Shanshan, et al. A new faster and safe nasal provocation test method for diagnosing mite allergic rhinitis. Ann Allergy Asthma Immunol. 2015;115:385-90.
2. Terada N, Konno A, Togawa K. Biochemical properties of eosinophils and their preferential accumulation mechanism in nasal allergy. J Allergy Clin Immunol. 1994;94:629-42.
3. Baraniuk JN. Pathogenesis of allergic rhinitis. J Allergy Clin Immunol. 1997;99:S763-S772.
4. Dordal MT, Lluch-Bernal M, Sanchez MC, Rondon C, Navarro A. Allergen-specific nasal provocation testing: Review by Rhinoconjunctivitis Comittee of the Spanish Society of Allergy and Clinical Immunol. 2011;21:1-12.
5. Rondon C, Campo P, Togias A, Fokkens WJ, Durham SR, Powe DG, et al. Local allergic rhinitis: concept, pathophysiology, and management. J Allergy Clin Immunol. 2012;129:1460-7.
6. Solomon WR. Nasal provocation testing. In Spector SL, editor. Provocation testing in clinical practice. New York: Marcel Dekker; 1995. p. 647-92.
7. Lebel B, Bousquet J, Morel A, Chanal I, Godard P, Bernard-Michel F. Correlation between symptoms and the threshold for release of mediators, in nasal secretions during nasal challenge with grass-pollen grains. J Allergy Clin Immunol. 1988;82:869-77.



