Número Atual: Julho-Setembro 2017 - Volume 1 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Análise de prescrições de imunoglobulina humana endovenosa para situações clínicas não referendadas nos protocolos clínicos nacionais
Analysis of intravenous human immunoglobulin prescriptions for clinical situations not referenced in national clinical protocols
Christiane Rodrigues Spacil1; Denise Bueno1,2,3
DOI: 10.5935/2526-5393.20170041
1. Programa de Pós-graduaçao em Assistência Farmacêutica. Faculdade de Farmácia, Universidade Federal do Rio Grande do Sul (UFRGS), Porto Alegre, RS
2. Programa de Pós-graduaçao em Ensino em Saúde. Faculdade de Medicina, UFRGS, Porto Alegre, RS
3. Departamento de Produçao e Controle de Medicamentos. Faculdade de Farmácia, UFRGS, Porto Alegre, RS
Endereço para correspondência:
Christiane Rodrigues Spacil
E-mail: chrisspacil@hotmail.com
Submetido em: 15/06/2017
Aceito em: 21/07/2017.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVO: Avaliar para quais indicaçoes clínicas a imunoglobulina humana está sendo utilizada, considerando ser esse um medicamento de alto custo e autorizado pelos protocolos nacionais para diagnósticos específicos.
MÉTODOS: Trata-se de um estudo transversal, retrospectivo, baseado na busca de informaçoes através do prontuário eletrônico dos pacientes do Hospital de Clínicas de Porto Alegre no período de janeiro a dezembro de 2015.
RESULTADOS: Foram identificadas 191 prescriçoes, totalizando 116 pacientes que tiveram prescrita a imunoglobulina humana endovenosa (IGIV). Desses pacientes, 27 casos foram relacionados a 6 tipos de doenças autoimunes e que apresentam protocolos definidos. Esses protocolos auxiliam os profissionais da saúde quanto aos cuidados necessários de manejo medicamentoso. Os demais casos identificados nao constam nas indicaçoes previstas nos protocolos do Ministério da Saúde e representam mais de 75% dos pacientes atendidos. Nao foram identificados efeitos colaterais sistêmicos ou periféricos em nenhum caso.
CONCLUSAO: Foi possível identificar para quais indicaçoes clínicas está sendo realizada a administraçao de IGIV, evidenciando-se a necessidade de ampliaçao desse estudo para outras instituiçoes, como forma de sinalizar a necessidade de administraçao desse hemoderivado devido a segurança e efetividade no tratamento.
Descritores: Imunoglobulina, doenças autoimunes, segurança.
INTRODUÇAO
No Brasil, o Ministério da Saúde autoriza a dispensaçao de imunoglobulina humana endovenosa (IGIV) para oito situaçoes clínicas comprovadas: anemia hemolítica autoimune, aplasia pura adquirida crônica da série vermelha, dermatomiosite e poliomiosite, imunodeficiência primária com predominância de defeitos de anticorpos, imunossupressao no transplante renal, miastenia gravis, púrpura trombocitopênica idiopática e Síndrome de Guillain-Barré1.
Os efeitos adversos podem ser imediatos como anafilaxia, ou tardios como hemólise, meningite asséptica, isquemia cerebral, insuficiência renal ou infarto do miocárdio. As características do produto, como osmolaridade, pH, velocidade de infusao, concentraçao de açúcar e sódio, devem ser consideradas em relaçao ao quadro clínico do paciente, pois nenhuma imunoglobulina humana tem aprovaçao para todas as situaçoes clínicas, como relatos de trombose e nefropatia associada ao açúcar utilizado como estabilizante na formulaçao, por exemplo2,3.
As particularidades relatadas, o crescente uso off-label e a produçao limitada desse hemoderivado, ocasionou a necessidade de criaçao de diretrizes que orientassem os profissionais e delimitassem a indicaçao de imunoglobulina humana endovenosa4.
Este estudo objetiva analisar as prescriçoes de IGIV dos pacientes do Hospital de Clínicas de Porto Alegre (HCPA) que nao estao preconizados nos protocolos clínicos do Ministério da Saúde, com o intuito de quantificar para quais as indicaçoes clínicas estao sendo utilizadas e, identificar se o crescente consumo desse hemoderivado está relacionado ao uso off-label.
MÉTODO
Trata-se de um estudo com delineamento observacional, transversal, através da análise retrospectiva dos prontuários eletrônicos dos pacientes que foram internados no Hospital de Clínicas de Porto Alegre (HCPA) durante o ano de 2015.
Para a avaliaçao da utilizaçao de imunoglobulina humana endovenosa, a amostra estudada foi constituída de 116 pacientes, um total de 191 internaçoes, sendo considerados todos os pacientes que administraram IGIV, abrangendo toda a área hospitalar, sem restriçoes de idade, sexo ou naturalidade. Para a variável motivo da internaçao foi utilizada a Classificaçao Internacional de Doenças (CID-10) para padronizaçao dos resultados.
Foram excluídos do estudo, pacientes que nao informavam a justificativa de internaçao através do CID-10 e, pacientes que atendiam aos protocolos nacionais quanto as exigências clínicas e, por isso autorizavam a dispensaçao pela Secretaria de Saúde do Estado do Rio Grande do Sul. Também foram excluídos pacientes que reinternaram pelo mesmo motivo no período do estudo.
A tabulaçao dos dados foi realizada em planilha no software Excel® MS e a análise dos resultados, bem como a comparaçao de prevalências entre grupos, de acordo com as suas características segundo a análise estatística por meio do programa Statistical Package for the Social Sciences (SPSS) 18.
De acordo com as exigências contidas na Resoluçao nº 466 de 2012, este estudo foi aprovado pela Comissao de Ética e Pesquisa do HCPA, com projeto sob número 15-0621.
RESULTADOS
Foram analisadas as prescriçoes de 116 pacientes no período de janeiro à dezembro de 2015, totalizando 191 internaçoes, porém 27 pacientes apresentaram o CID-10 que estava contemplado nos protocolos de saúde e que teriam o direito de acesso ao medicamento fornecido pela Secretaria de Saúde do Rio Grande do Sul. Esses 27 pacientes foram diagnosticados com os casos clínicos de Síndrome de Guillain-Barré, púrpura trombocitopênica idiopática, miastenia gravis, transplante renal, imunodeficiência com aumento de IgM e outras anemias hemolíticas autoimunes.
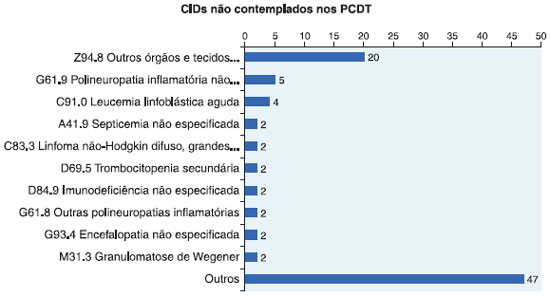
Para os diagnósticos nao contemplados nos protocolos foram totalizados 90 pacientes, representando mais de 75% dos casos e, que constavam na sua prescriçao a administraçao de imunoglobulina humana endovenosa (IGIV). Na Figura 1 é possível identificar e quantificar para quais indicaçoes clínicas foram prescritas a IGIV, que está representada pela distribuiçao dos motivos de internaçao dos pacientes, agrupados de acordo com o sistema afetado para CID-10 que apresentaram mais de 2 casos repetidos.
Considerando o número representativo de dados, para os achados com incidência menor de 2 casos, esses foram agrupados e denominados como "outros", e estao vinculados a casos clínicos de alergia nao especificada, artrite reumatoide juvenil, lúpus eritematoso, cistite e displasia de vulva nao especificada, choque cardiogênico, micoses oportunistas, desnutriçao proteico-calórica grave nao especificada, por exemplo (Figura 2).
Nao foram observados efeitos colaterais sistêmicos ou periféricos relacionados a administraçao de IGIV para nenhum paciente do estudo.
DISCUSSAO
A imunoglobulina humana foi a primeira e mais bem estabelecida das indicaçoes para a terapia de reposiçao em pacientes portadores de síndromes de imunodeficiência primária, tais como a hipo ou a agamaglobulinemia congênitas, a Síndrome da imunodeficiência combinada grave, a imunodeficiência comum variável e a Síndrome de Wiskott-Aldrich. Estes pacientes apresentam uma ausência ou grande diminuiçao nos níveis séricos de imunoglobulinas, ficando assim muito susceptíveis a infecçoes. A terapia de reposiçao com imunoglobulina corrige o problema e previne a susceptibilidade às infecçoes. Diversos estudos comprovaram a eficácia e a inocuidade desta abordagem, que se tornou o padrao ouro para estas situaçoes clínicas5-7.
Foram descritos mais de 250 imunodeficiências primárias distintas e com o advento de sequenciamento genético, novas imunodeficiências serao descobertas a um ritmo muito rápido e, portanto as indicaçoes de imunoglobulina humana precisam acompanhar esse processo para terapêutica desses pacientes, como os relatos identificados na pesquisa, considerando que a maioria das doenças de imunodeficiência primária envolve a deficiência de anticorpos5.
O protocolo do Ministério da Saúde preconiza a dispensaçao de imunoglobulina humana para pacientes com imunodeficiência primária com predominância de defeitos de anticorpos, mas nao inclui nessa lista os pacientes com imunodeficiência com predominância de defeitos de anticorpos nao especificada, imunodeficiência nao especificada e imunodeficiência comum variável nao especificada, porém foi a terapia de escolha para tratar alguns casos encontrados neste estudo. O Canadá reconhece e licencia a imunoglobulina humana endovenosa para o tratamento de imunodeficiência primária e doenças de imunodeficiência secundárias8.
Há diversos estudos que demonstram que o uso de imunoglobulinas em pacientes submetidos a transplante de medula óssea reduz a frequência e a gravidade das septicemias, além de diminuir a intensidade da doença do enxerto contra hospedeiro. Esta indicaçao é hoje considerada uma das indicaçoes formais para o uso das imunoglobulinas, tanto na Europa quanto nos Estados Unidos, porém nao consta nos protocolos essa terapia para pacientes com rejeiçao a transplante de medula óssea, mas foi a terapia de escolha para dois casos encontrados no estudo9.
A Portaria nº 712/2014 que aprova o protocolo para imunossupressao no transplante renal autoriza a dispensaçao de imunoglobulina para esses pacientes, porém nao atesta para outros casos submetidos a transplante de fígado ou outros órgaos, como identificados 63 pacientes no estudo e que foram submetidos a terapia com imunoglobulina humana. Um estudo nao controlado, com pequeno número de pacientes, sugeriu que as imunoglobulinas contribuem para a reversao da rejeiçao ao transplante renal resistente às outras formas de imunossupressao. Outros dois relatos de pequenas séries de pacientes indicam que as imunoglobulinas podem contribuir para dessensibilizar os pacientes com alto grau de imunizaçao aos anticorpos anti-HLA pré-transplante10-12.
A evoluçao da imunoglobulina humana para transplante de órgaos sólidos como fonte de imunidade passiva em pacientes imunodeficientes a atividade imunomoduladora e anti-inflamatória foi notável, e o uso de IGIV em receptores de transplante de órgaos tem crescido significativamente nas últimas décadas. Os protocolos atuais incluem o uso de IVIG em baixa dose com plasmaférese ou IVIG de dose elevada com ou sem depleçao de células B usando rituximab. Apesar desta considerável experiência, ainda nao há aprovaçao do FDA, embora os dados clínicos sejam favoráveis. Em geral, o uso de IVIG para dessensibilizaçao tem sido utilizada como agente de dessensibilizaçao em pacientes aguardando transplantes de coraçao e pulmao. Os dados nao sao robustos quanto os observados no transplante renal12-13.
A Doença de Kawasaki é uma vasculite que acomete crianças e adolescentes e que tem, como grande complicaçao, o surgimento de aneurismas coronarianos. O uso de imunoglobulinas, sempre associadas à aspirina, produz uma resposta clínica, desaparecendo a febre e prevenindo a formaçao dos aneurismas em uma grande proporçao de casos. Esta conclusao foi obtida em 1986, a partir do estudo de Newburger e colaboradores que testou em 154 crianças com a doença, a eficácia das imunoglobulinas associadas à aspirina, comparando-a com a da aspirina isolada. Os resultados deste estudo randomizado e controlado foram extraordinariamente superiores no grupo que recebia imunoglobulinas (frequência de 18% de aneurismas no grupo que recebia apenas aspirina, versus 4% no grupo que recebia imunoglobulinas)14.
Desde entao, as imunoglobulinas passaram a ser consideradas a forma mais adequada de tratamento da Doença de Kawasaki, o que tem sido confirmado em diversos outros estudos, e em uma grande metanálise feita pelo grupo Cochrane, que concluiu que o uso precoce das imunoglobulinas até 10 dias depois do início dos sintomas diminui drasticamente a frequência de aparecimento de aneurismas, mesmo naqueles pacientes que já apresentavam algum aneurisma ao iniciar o tratamento. No Brasil ainda nao constam protocolos que autorizam a dispensaçao de imunoglobulina humana para esses casos clínicos, porém foi a terapia de escolha para dois casos isolados encontrados no estudo realizado15.
A trombocitopenia neonatal autoimune é uma doença pouco frequente, que acomete 1 em cada 2.000 recém-nascidos. A criança acometida apresenta graus variáveis de trombocitopenia, devido à passagem transplacentária de anticorpos produzidos pela mae e dirigidos contra antígenos específicos das plaquetas. Nas formas graves pode haver hemorragias espontâneas, inclusive cerebrais, que colocam em risco o prognóstico da criança. A administraçao materna de imunoglobulinas, nos casos em que a doença é diagnosticada no período pré-natal, é hoje considerada o padrao ouro para o tratamento da doença, reservando-se as transfusoes intrauterinas de plaquetas para os casos de trombocitopenia intensa16,17.
O resultado do uso das imunoglobulinas na sepse tem sido controverso. Uma metanálise, feita pelo grupo Cochrane, de 27 estudos controlados e randomizados, mostrou que o uso das imunoglobulinas reduzia significativamente a mortalidade e era um adjuvante muito promissor no tratamento da sepse. No entanto, todos os ensaios incluídos na metanálise tinham um pequeno número de pacientes18.
O segundo estudo recrutou 39 pacientes internados por traumas em unidades de terapia intensiva, e randomizados para receber imunoglobulina ou albumina (além de antibioticoterapia), e demonstrou que o grupo tratado com imunoglobulinas apresentava uma reduçao na frequência das complicaçoes sépticas, embora nao houvesse diferença na mortalidade. Todas estas evidências indicam que o uso das imunoglobulinas nas septicemias pode ser classificado como aceitável, o que confere a terapêutica adotada para cinco casos de septicemia encontrados no estudo, mas que nao constam em protocolos do Ministério da Saúde19.
A artrite reumatoide juvenil é uma indicaçao experimental, e a artrite reumatoide do adulto é uma indicaçao nao fundamentada para as imunoglobulinas, porém foi administrado para um caso isolado encontrado no estudo. As imunoglobulinas tiveram algum efeito benéfico em pacientes com artrite reumatoide com comprometimento visceral, e também em pacientes com artrite reumatoide juvenil, em alguns estudos. Na artrite reumatoide clássica do adulto, as imunoglobulinas nao demonstraram ser eficazes20,21.
As agências oficiais como a European Agency for the Evaluation of Medicinal Products (EMEA) e a Food and Drug Administration (FDA) reconhecem, apenas, algumas poucas situaçoes como indicaçoes absolutas para a utilizaçao das imunoglobulinas. Estas restriçoes, porém, nao têm impedido o chamado uso offlabel das imunoglobulinas, em crescimento constante. Para além das diretrizes "oficiais", muitas associaçoes médicas, sociedades de especialistas e grupos de experts têm emitido suas próprias recomendaçoes para a utilizaçao das imunoglobulinas22,23.
Considerando o exposto e mesmo diante de diretrizes e protocolos nacionais que orientem quanto às indicaçoes previstas para o uso adequado desse hemoderivado, o que observamos é o que uso off-label permanece vigente e, por isso, mais estudos precisam ser fundamentados para auxiliarmos as agências reguladoras quanto a segurança dos pacientes que usufruem desse medicamento.
Os protocolos clínicos do Ministério da Saúde sao fundamentais na saúde pública no Brasil, pois possibilitam o acesso a medicamentos para tratamento de doenças de alta complexidade e, ao mesmo tempo, representam grande impacto financeiro no orçamento das esferas de gestao, por isso precisam estar em constante transformaçao, buscando aprimorar as pesquisas baseadas em evidências e estratégias que assegurem e ampliem o acesso da populaçao aos serviços de saúde.
As instituiçoes de saúde precisam dialogar constantemente com as Agências Reguladoras que regulamentam a administraçao de imunoglobulina humana endovenosa, a fim de formalizar e adequar a administraçao segura e eficaz, orientando os profissionais da saúde na escolha da terapêutica adotada, considerando a ampliaçao de acesso ao medicamento quanto a necessidade e melhora do quadro clínico do paciente.
CONCLUSAO
Por meio dessa pesquisa, foi possível identificar a utilizaçao de IGIV para casos clínicos que nao apresentam protocolos que regulamentam a dispensaçao e representam a maioria dos casos atendidos no período do estudo, o que vai ao encontro dos mais de 90 casos considerados off-label e, por isso deve ser ampliado esse estudo para outras instituiçoes a fim de argumentar e comprovar uma atençao maior quanto ao acesso a esse medicamento considerando a segurança e eficácia no tratamento.
AGRADECIMENTOS
Ao Programa de Pós-graduaçao em Assistência Farmacêutica da Universidade Federal do Rio Grande do Sul, e ao Hospital de Clínicas de Porto Alegre, em especial ao Serviço de Farmácia, que souberam compartilhar de todo conhecimento para que fosse possível realizar este trabalho.
REFERENCIAS
1. Brasil. Ministério da Saúde. Documentos e exames necessários para solicitaçao administrativa de medicamentos do componente especializado da assistência farmacêutica V, jun. 2015.
2. Siegel J. The product: All intravenous immunoglobulins are not equivalent. Pharmacotherapy. 2005;25(11Pt2):78S-84S.
3. Nydegger U. (1994). Old and new views on intravenous immunoglobulin therapy. Schweizerische Medizinische Wochenschrift. 1994;124(1-2):5-25.
4. Antônio Eduardo Vieira dos Santos. Infusao de imunoglobulina intravenosa em crianças com imunodeficiência primária. Tese (Doutorado em Saúde da Mulher e da Criança), Instituto Fernandes Figueira, Rio de Janeiro, RJ, 2012.
5. Buckley RH, Schiff RI. The use of intravenous immune globulin in immunodeficiency diseases. N Engl J Med. 1991;325:110-7.
6. Nydegger UE, Mohacsi PJ, Escher R, Morell A. Clinical use of intravenous immunoglobulins. Vox Sang. 2000;78(Suppl2):191-5.
7. Ratko TA, Burnett D A, Foulke GE, Matuszewski KA, Sacher RA. Recommendations for off-label use of intravenously administered immunoglobulin preparations. University Hospital Consortium Expert Panel for Off-Label Use of Polyvalent Intravenously Administered Immunoglobulin Preparations.[comment]. Jama. 1995;273(23):1865-70.
8. Anderson D, Ali K, Blanchette V, Brouwers M, Couban S, Radmoor P, Rock G. (2007). Guidelines on the use of intravenous immune globulin for hematologic conditions. Transfusion Medicine Reviews. 2007;21(Suppl. 1):S9-S56.
9. Tellier Z, Mouthon L. Les indications therapeutiques des immunoglobulines intraveineuses. In Transfusion Clinique et Biologique. 2003;10:179-84.
10. Brasil. Ministério da Saúde. Portaria n° 712, de 13/08/2014.
11. Glotz D, Haymann JP, Sansonetti N, Francois A, Menoyo-Calonge V, Bariety J, et al. Suppression of HLA-specific alloantibodies by high-dose intravenous immunoglobulins (IVIg). A potential tool for transplantation of immunized patients. Transplantation. 1993;56:335-7.
12. Glotz D, Antoine C, Julia P, Suberbielle-Boissel C, Boudjeltia S, Fraoui R, et al. Desensitization and subsequent kidney transplantation of patients using intravenous immunoglobulins (IVIg). American Journal of Transplantation. 2002;2(8):758-60.
13. Vo A, Lukovsky M, Toyoda M, Wang J, Reinsmoen NL, Lai CH, et al. Rituximab and intravenous immune globulin for desensitization during renal transplantation. N Engl J Med. 2008;359(3):242-51.
14. Newburger J, Takahashi M, Burns JC, Beiser AS, Chung KJ, Duffy CE, et al. The treatment of Kawasaki syndrome with intravenous gamma globulin. N Engl J Med. 1986;315(6):341-7.
15. Oates-Whitehead R, Baumer J, Haines L, Love S, Maconochie I, Gupta A, Flynn I. Intravenous immunoglobulin for the treatment of Kawasaki disease in children. Cochrane Database of Systematic Reviews (Online). 2003.(4). CD004000.
16. Sainio S, Teramo K, Kekomäki R. Prenatal treatment of severe fetomaternal alloimmune thrombocytopenia. Transfusion Medicine. 1999;9(4):321-30.
17. Birchall JE, Murphy MF, Kaplan C, Kroll H. European collaborative study of the antenatal management of feto-maternal alloimmune thrombocytopenia. British Journal of Haematology. 2003;122(2):275-88.
18. Alejandria MM, Lansang MA, Dans LF, Mantaring JB. Intravenous immunoglobulin for treating sepsis and septic shock. Cochrane Database of Systematic Reviews (Online : Update Software), (2). 2000. CD001090.
19. Douzinas EE, Pitaridis MT, Louris G, Andrianakis I, Katsouyanni K, Karmpaliotis D, Roussos C. Prevention of infection in multiple trauma patients by high-dose intravenous immunoglobulins. Critical Care Medicine. 2000;28(1):8-15.
20. Matteson EL. Recent clinical trials in the rheumatic diseases. Current Opinion in Rheumatology. 1997;9(2):95-101.
21. Pyne D, Ehrenstein M, Morris V. The therapeutic uses of intravenous immunoglobulins in autoimmune rheumatic diseases. Rheumatology. 2002;41:367-74.
22. European Agency for the Evaluation of Medicinal Products (EMEA). Core SPC for Human Normal Immunoglobulin for intravenous Administration (IVIG) [Internet]. EMEA; Core SPC for Human Normal Immunoglobulin for Intravenous Administration (IVIg) [citado 2016 fev 20]. Disponível em: http://www.ema.europa.eu/ema/index.jsp?curl=pages/includes/ document/document_detail.jsp?webContentId=WC500067337& murl=menus/document-library/document_library.jsp&mid=WC0b 01ac058009a3dc&jsenabled=true
23. Knezevic-Maramica I, Kruskall MS. Intravenous immune globulins: an update for clinicians. Transfusion. 2003 Oct;43(10):1460-80. Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/14507280